
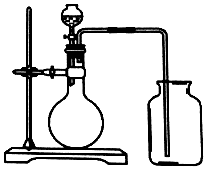
| A. | 锌和稀硫酸 | B. | 碳酸钙和硫酸 | ||
| C. | 过氧化氢和二氧化锰 | D. | 硫酸铵和氢氧化钠 |
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 71gCl2所含原子数为NA | |
| C. | 在常温常压下,1molNe含有的原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
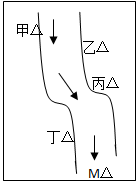 在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.
在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101kPa下氢气的燃烧热△H=-285.8 kJ•mol-1,则水分解的热化学方程式:2 H2O (l)=2H2 (g)+O2 (g)△H=+285.8 kJ•mol-1 | |
| C. | Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2akJ•mol-1,则任何强酸和强碱发生中和反应生成1molH2O(l)的反应热均为-akJ•mol-1 | |
| D. | 1g甲烷完全燃烧生成液态水的过程中放出55.6kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3在水溶液中的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | NaHCO3溶液与NaOH溶液反应的离子方程式为H++OH-=H2O | |
| C. | NH4NO3溶液与NaOH稀溶液反应的离子方程式为NH4++OH-=NH3•H2O | |
| D. | NH4NO3溶液与足量Ba(OH)2溶液反应的离子方程式为Ba2++CO32-=BaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为Mg-2e-═Mg2+ | |
| B. | 负极可能会发生副反应Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 电池放电时Cl-由负极向正极迁移 | |
| D. | 正极反应式为AgCl+e-═Ag+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
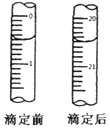 检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
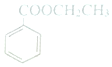
| A. | 分子式为C9H10O2 | |
| B. | 能发生取代、加成反应 | |
| C. | 苯环上的一氯代物有3种 | |
| D. | 在酸性条件下水解产物均能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com