
| A、①②⑥ | B、①④⑤ |
| C、③④ | D、②⑥ |


科目:高中化学 来源: 题型:
| A、升温 | B、加压 |
| C、加水稀释 | D、滴加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHCO3溶液中滴加少量溴水:HCO3-+Br2═HBrO+Br-+CO2↑ |
| B、向Na2CO3溶液中滴加少量溴水:2CO32-+Br2+H2O═BrO-+Br-+2HCO3- |
| C、向NaBrO溶液中通入过量的CO2:CO2+2NaBrO+H2O═Na2CO3+2HBrO |
| D、向NaBrO溶液中通入少量的CO2:CO2+NaBrO+H2O═NaHCO3+HBrO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3胶体有较强的吸附作用,是因为胶粒有较大的表面积 |
| B、白磷熔化、干冰汽化、SiO2熔化、AlCl3升华都是克服分子间作用力 |
| C、液晶是一种介于晶体和液体之间的中间态物质,分子较小,在信息技术中作用较大 |
| D、电解质熔融时一定能导电,因为破坏了化学键产生自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
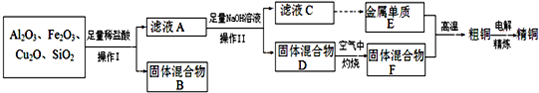
查看答案和解析>>
科目:高中化学 来源: 题型:
 某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有Fe2+存在,一定没有Fe3+、Mg2+ |
| B、一定有Fe3+存在,一定没有Fe2+、Mg2+ |
| C、一定有Fe3+存在,可能有Fe2+,一定没有Mg2+ |
| D、一定有Fe2+ 存在,可能有Mg2+,一定没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com