
下列说法正确的是
A.镀层破损后白铁(镀锌铁)比马口铁(镀锡铁)中的铁更易腐蚀
B.SO2(g) + 2H2S(g) = 3S(s)+2H2O(l) 在常温下能自发进行,则该反应的△H>0
C.0.1 mol·L-1CH3COOH溶液中加入少量水,CH3COOH电离程度和溶液pH均增大
D.在N2+3H2 2NH3平衡体系中加入少量催化剂,反应速率和平衡常数均增大
2NH3平衡体系中加入少量催化剂,反应速率和平衡常数均增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在强酸性溶液中,下列离子组能大量共存的是( )
A.Na+、Al3+、NO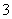 、Cl- B.K+、Na+、Cl-、AlO
、Cl- B.K+、Na+、Cl-、AlO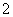
C.Fe2+、K+、NO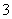 、Cl- D.Na+、HCO
、Cl- D.Na+、HCO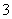 、K+、NO
、K+、NO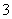
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示。F和J是中学化学中常见的两种单质。H为红棕色气体。图中部分反应条件及生成物没有列出。请按要求填空:
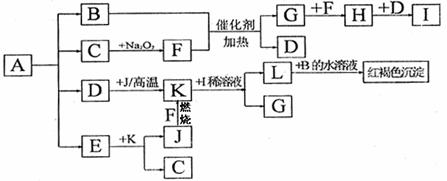
(1)单质F的化学式
(2)写出B和F反应的化学方程式 ,L和B的水溶液反应的离子方程式 ;
(3)写出K与I的稀溶液反应的离子方程式
(4)A的化学式为
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4,反应有G生成,该反应的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置应用于实验室由粗铜制取NO2气体并回收硝酸铜的实验,能达到实验目的的是
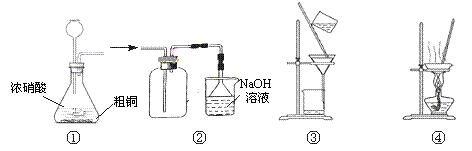
A.用图①装置制备NO2
B.用图②装置收集NO2
C.用图③装置,过滤时不断搅拌溶液以过滤除去固体杂质
D.用图④装置,蒸发至干得纯净的Cu(NO3)2·3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用电石渣(主要含CaO、CaC2及少量C、SiO2)为原料制备氯酸钾的实验流程及相关物质的溶解度如下:
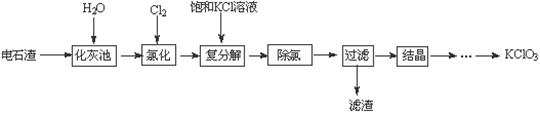
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(1) 化灰池中CaC2与水反应的化学方程式为 。
(2)在80℃氯化时产生氯酸钙及氯化钙的化学方程式为 ;除去溶液中多余的氯气的简单方法是 。
(3)饱和KCl溶液能与氯酸钙反应的原因是 。
(4)滤渣中的成分主要是 (写化学式);从过滤后的溶液中获得KClO3晶体的方法是 、 、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A
和1.0 mol B,反应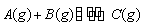 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A、反应在前5 s的平均速率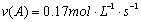
B、保持其他条件不变,升高温度,平衡时 ,则反应的
,则反应的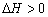
C、相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
| ③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(1)实验①得出的结论___________________________________。
(2)指出实验②和实验④中的“实验现象”:
②________,④________。
(3)实验③中“实验方法”的具体操作过程是:______________
______________________________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a._________________________ ______________,
b.___________________________________________________。
请设计简单的实验证明哪一个是正确的____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
40.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
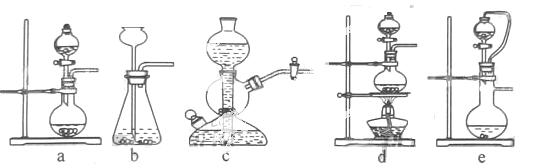
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
41.若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠
g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g (保留一位小数)。
42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
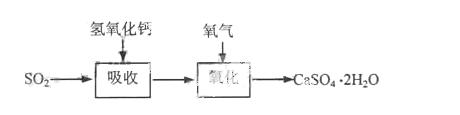
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
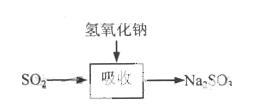
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com