
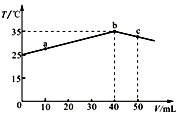
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | c点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 |
分析 A.a→b的过程中,溶液体积增大,但溶液中n(A-)与n(HA)之和始终不变;
B.酸碱中和是放热反应,弱酸的电离是吸热过程,混合溶液温度达到最高时,酸碱恰好完全反应,根据图知,b点酸碱恰好完全反应;
C.加入40mLNaOH溶液时二者恰好完全反应,则c(HA)=$\frac{0.1mol/L×0.04L}{0.05L}$=0.08mol/L>c(H+),则HA是弱酸,等浓度的NaOH和NaA混合溶液中,NaOH电离和NaA水解都生成OH-,只有NaA电离生成A-;
D.HA的电离平衡常数Ka=$\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$.
解答 解:A.a→b的过程中,溶液体积增大,但溶液中n(A-)与n(HA)之和始终不变,溶液体积增大,导致溶液中c(A-)与c(HA)之和减小,故A错误;
B.酸碱中和是放热反应,弱酸的电离是吸热过程,混合溶液温度达到最高时,酸碱恰好完全反应,根据图知,b点酸碱恰好完全反应,c点碱过量,故B错误;
C.加入40mLNaOH溶液时二者恰好完全反应,则c(HA)=$\frac{0.1mol/L×0.04L}{0.05L}$=0.08mol/L>c(H+),则HA是弱酸,等浓度的NaOH和NaA混合溶液中,NaOH电离和NaA水解都生成OH-,只有NaA电离生成A-,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(A-)>c(H+),故C错误;
D.HA的电离平衡常数Ka=$\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$=$\frac{(1{0}^{-2})^{2}}{0.08-0.01}$≈1.43×10-3,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析、判断、计算能力,明确溶液温度与酸碱反应关系、基本概念是解本题关键,注意D中近似计算,易错选项是A,很多同学易利用物料守恒判断“c(A-)与c(HA)之和始终不变”而导致错误.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
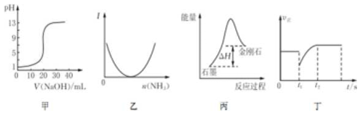
| A. | 图甲表示0.10mol•L-1NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 | |
| D. | 图丁表示反应2SO2+O2?2SO3,t1时刻只减小了 SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
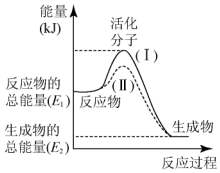 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | 电子流动方向为a→导线→b | |
| B. | H+经质子交换膜由右向左移动 | |
| C. | 放电一段是时间b极附近pH不变 | |
| D. | a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Mg 在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com