
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,含有自由移动电子或离子的物质能导电.
解答 解:①干冰即固态的二氧化碳,无自由移动的电子或离子,不导电;在熔融状态下不导电,在水溶液中导电和其本身无关,故为非电解质;
②NaCl晶体不导电,但其溶于水或熔融状态下能导电,故为电解质;
③氨水能导电,但由于是混合物,故既不是电解质也不是非电解质;
④铜能导电,但由于是单质,故既不是电解质也不是非电解质;
⑤熔融的KOH能导电,由于熔融的氢氧化钾能导电,故是电解质.
故属于电解质的是②⑤,非电解质的是①,能导电的是③④⑤.
故答案为:②⑤;①;③④⑤.
点评 本题考查了电解质、非电解质的概念及导电性、等知识,较基础,注意根据定义来分析.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | |
| B. | R的最高价氧化物的水化物酸性比W的强 | |
| C. | W的气态氢化物的热稳定性比Y的强 | |
| D. | Y的无氧酸能用于蚀刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KNO3$\frac{\underline{\;\;△\;\;}}{\;}$2KNO2+O2↑ | B. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | SO2+2H2S═3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A可由葡萄糖发酵得到.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验.
有机物A可由葡萄糖发酵得到.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验.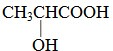 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
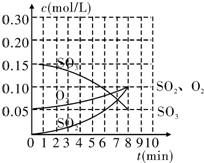 在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.| 选项 | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na202在潮湿的空气中放置一段时间,变成白色贴稠物的原因是2Na202+2CO2=2Na2CO3+O2 | |
| B. | Na202用作呼吸面具中的供氧剂,不涉及氧化还原反应 | |
| C. | 常温常压下,Na202与足量H2O反应生成0.2mol O2时,转移的电子为0.2mol | |
| D. | 将钠放在空气中的变化过程为Na→Na2O→Na0H→Na2CO3•10H2O→Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com