

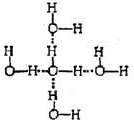
���� ��1�������Ȼ��Ƶľ����ṹ֪������þ��þԭ�Ӻ�þԭ�Ӵ���С�����εĶԽ����ϣ�
��2�������Ȼ��ƾ����������ӻ������ӵ���λ���ж���ṹͼ�Ƿ���ȷ�������ӻ������ӵ���λ������6��
��3�����Ӵӽϸ������ļ���̬ԾǨ���ϵ������ļ���̬������̬ʱ�����ͷ�������
��4���ٸ�ˮʩ��һ�����糡���γ��ȱ���ˮ�����й�������У�˵��ˮ������������ɵ����IJ��غϣ����м��ԣ�
�ڱ������д��������������з����ԣ�ÿ��ˮ���������ڵ�4��ˮ�����γ������
��5�����ݸɱ��ľ����ṹ��֪��������̼���������������ṹ����ѻ���ʽ��ͭ����������ͬ������ͭ�����Ľṹ��֪���������϶Խ������ʵ�3��ͭԭ�����ڣ���Cuԭ�Ӱ뾶Ϊr����������$\frac{\sqrt{2}}{2}$��4r���������㾧������������ݾ�̯�����㾧����Cuԭ����Ŀ���������㾧����Cuԭ��ʵ��ռ�е�����������ռ�������=������Cuԭ��ʵ��ռ�е�����¾��������
��� �⣺��1�������Ȼ��Ƶľ����ṹ֪������þ��þԭ�Ӻ�þԭ�Ӵ���С�����εĶԽ����ϣ�����ͼ��֪����Ӧ��Ϊ��ɫ��
�ʴ�Ϊ���������Ϊ��ɫ��
��2��������NaCl�����У�ÿ��Na+��Χͬʱ����������ĵȾ����6��Cl-ͬ��ÿ��Cl-��Χͬʱ����������ĵȾ����6��Na+��ͼb�з���������ͼc��ѡȡ����һ�����ӣ�Ȼ����X��Y��Z�����и�õ�6���Ⱦ����������Ĵ��෴��ɵ����ӣ���������λ��Ҳ��6���ʷ���������
��ѡbc��
��3�����Ӵӽϸ������ļ���̬ԾǨ���ϵ������ļ���̬������̬ʱ�����ͷ����������������ԭ�Ӻ�����ӷ���ԾǨ�ͷ������йأ�
�ʴ�Ϊ�����Ӵӽϸ������ļ���̬ԾǨ���ϵ������ļ���̬������̬ʱ�����ͷ�������
��4���ٸ�ˮʩ��һ�����糡���γ��ȱ���ˮ�����й�������У�˵��ˮ������������ɵ����IJ��غϣ����м��ԣ�
�ʴ�Ϊ������
�ڱ�������ˮ���ӵĿռ����з�ʽ���������д��������������з����ԣ�ÿ��ˮ���������ڵ�4��ˮ�����γ������
�ʴ�Ϊ�� ��
��
��3�����ݸɱ��ľ����ṹ��֪��������̼���������������ṹ����ѻ���ʽ��ͭ����������ͬ���������϶Խ������ʵ�3��Cuԭ�����ڣ���Cuԭ�Ӱ뾶Ϊr���������ⳤ=$\frac{\sqrt{2}}{2}$��4r=2$\sqrt{2}$r�����������=$��{2\sqrt{2}r��}^{3}$=16$\sqrt{2}$r3��������Cuԭ����Ŀ=8��$\frac{1}{8}$+6��$\frac{1}{2}$=4��������Cuԭ��ʵ��ռ�е����=4��$\frac{4}{3}$��r3�������ռ�������=$\frac{4��\frac{4}{3}��{r}^{3}}{16\sqrt{2}{r}^{3}}$=74%�����Զ�����̼�����Ŀռ�������ҲΪ74%��
�ʴ�Ϊ��74%��ͭ��
���� ���⿼�������ʽṹ�����ʵ��й�֪ʶ��ͬʱ����ѧ���Ŀռ������������������⼰��������������Ѷ��еȣ����⿼���˵��ӵ��ܼ�ԾǨ�������Ŀռ������ʵļ��㡢����ȣ��Ѷ��еȣ�ע��Ի���֪ʶ���������գ�ע�⿴�徧�����й�ԭ�����ڵ�λ�ã�


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��2���ϳɰ��ķ�Ӧԭ��Ϊ��
��2���ϳɰ��ķ�Ӧԭ��Ϊ��| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 2mol��H2��2molN2 | 4mol��H2��4molN2 | 2mol��NH3 |
| ƽ��ʱN2��Ũ�ȣ�mol•L-1�� | c1 | 1.5 | C3 |
| ƽ��ʱN2��������� | w1 | W2 | W3 |
| ���������ܶȣ�g•L-1�� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������ز�Ʒ�����������Ӧ�ù㷺��
����������ز�Ʒ�����������Ӧ�ù㷺��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ��ͬѹ�£���ͬ��������ʣ����ǵ����ʵ�������� | |
| B�� | �κ������£������ʵ�����Cl2��HCl�����ķ���������� | |
| C�� | 1LHCl����һ����1L Cl2���������С | |
| D�� | 22.4LHCl��������ʵ���ǡ����11.2LHCl��������ʵ����Ķ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 molCu��������Ũ���ᷴӦ������NA��SO3���� | |
| B�� | 3mol����Fe��ȫת��ΪFe3O4��ʧȥ8 NA������ | |
| C�� | ����������ˮ��Ӧʱ������0.1mol����ת�Ƶĵ�����Ϊ0.4NA | |
| D�� | �ܱ�������2molNO��1molO2��ַ�Ӧ������ķ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ���Ǿ�����ͬ�˵������ͬһ��ԭ�ӵ��ܳ� | |
| B�� | ���ش���һ��ԭ�� | |
| C�� | ijԪ�ص�һ�ֺ��ش�����Ԫ�ص�һ��ԭ�� | |
| D�� | ij��ͬλ�ػ���ش�����Ԫ�ص�һ��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ���ȳʺ�ɫ����Һ�У�Na+��AlO2-��NO3-��CO32- | |
| B�� | ��ˮ���������c��H+��=10-12mol•L-1����Һ��NH4+��SO42-��HCO3-��Cl- | |
| C�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��1014����Һ��Ca2+��Na+��ClO-��NO3- | |
| D�� | $\frac{{K}_{W}}{c��{H}^{+}��}$=0.1 mol•L-1����Һ��Na+��K+��CO32-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com