
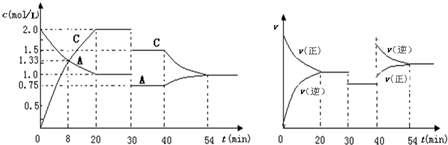
| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
分析 A.0~20minA的浓度变化为1mol/L,根据v=$\frac{△c}{t}$计算;
B.40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应;
C.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,由30-40min内平衡不移动,速率减小可知改变条件是减小压强;
D.由30-40min减小压强,平衡常数不变,40min时升高温度K减小.
解答 解:A.由图象可知,0~20minA的浓度变化为1mol/L,v(A)=$\frac{1mol/L}{20min}$=0.05mol•L-1•min-1,故A错误;
B.40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则改变压强平衡不移动,30min时,正逆反应速率都减小,而且平衡不移动,所以改变条件是减小压强,故C正确;
D.由以上分析可知30-40min减小压强,平衡常数不变,所以K2=K1,40min时升高温度,平衡逆移K减小,所以K2=K1>K3,故D错误;
故选C.
点评 本题考查化学平衡图象问题,题目难度较大,本题注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响化学反应速率的条件,本题易错,答题时注意思考.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中加入AgNO3溶液得白色沉淀,加稀盐酸不消失,可能存在Cl-或SO42- | |
| B. | 无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,则一定含有SO42- | |
| C. | 用CCl4萃取碘水中的碘,下层呈紫红色 | |
| D. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、CH3COONa、BaSO4 | B. | NH4Cl、H2O、Na2S | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 33.3% | C. | 60% | D. | 36% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com