
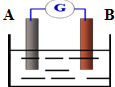
 如图为某原电池装置:
如图为某原电池装置:分析 (1)若A为Zn,B为石墨,电解质溶液为稀硫酸,该原电池中,Zn易失电子作负极、石墨作正极,所以A电极上锌失电子生成锌离子进入溶液;
(2)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,Fe易失电子作负极、Cu作正极,正极上铁离子得电子生成亚铁离子.
解答 解:(1)若A为Zn,B为石墨,电解质溶液为稀硫酸,该原电池中,Zn易失电子作负极、石墨作正极,所以A电极上锌失电子生成锌离子进入溶液,电极反应式为,故答案为:Zn-2e-=Zn2+;
(2)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,Fe易失电子作负极、Cu作正极,正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e-=Fe2+,故答案为:正; Fe3++e-=Fe2+.
点评 本题考查原电池原理,为高频考点,侧重考查电极反应式的书写,正确判断正负极及各个电极上发生的反应是解本题关键,会正确书写电极反应式,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,1.8g H2O含有0.2nA个H-O共价键 | |
| B. | 1L 0.3 mol•L-1的FeCl3溶液中Fe3+数目为0.3nA | |
| C. | 标准状况下,22.4L CCl4中含 nA个CCl4分子 | |
| D. | 标准状况下,22.4L NO2和CO2的混合气体含有2nA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
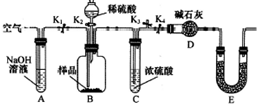 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 升高温度可加快逆反应速率但不能改变正反应速率 | |
| C. | 一定条件下,SO2可100%转化为SO3 | |
| D. | 任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com