
| 1000ρω |
| M |
| V |
| Vm |
| n |
| C |
| n |
| V |
| 1000×1.14g?mL-1×14% |
| 40g/mol |
| 2.24L |
| 22.4L/mol |
| 0.2mol |
| 4.0mol/L |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、K+、Cl-、HCO3-、SO42- |
| B、Mg2+、Cl-、Al3+、SO42- |
| C、Ca2+、Fe3+、Na+、NO3- |
| D、Ba2+、Cl-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出:查看答案和解析>>
科目:高中化学 来源: 题型:
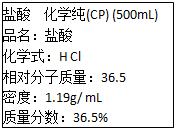 如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:
如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
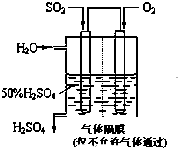 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:| 1 |
| 2 |
| 10 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com