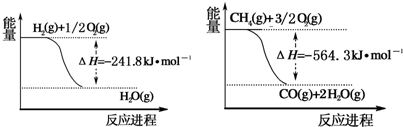
解答:解:(1)反应CH
4(g)+H
2O
CO(g)+3H
2(g),可由反应①2CH
4(g)+3O
2(g)→2CO+4H
2O(g),②2H
2(g)+O
2(g)→2H
2O(g)合并而成,即
,根据盖斯定律,结合图中数据,可以求得焓变△H=
kJ?mol
-1=+161.1 kJ?mol
-1,
故答案为:+161.1 kJ?mol
-1;
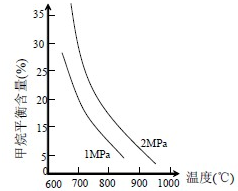
(2)①由图象可知,其他条件不变,升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动,
故答案为:其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动;
②参加反应的CH
4为:1mol×80%=0.8mol,所以生成的氢气为:n(H
2)=3n(CH
4)=2.4mol,v(H
2)=
=
=0.4 mol/(L?min),
在反应CH
4(g)+H
2O
CO(g)+3H
2(g)中,平衡时CH
4的物质的量为:1mol-0.8mol=0.2mol,
依据化学方程式可知,H
2O的物质的量为0.2mol,CO的物质的量为0.8mol,H
2的物质的量为2.4mol,而容器体积为1L,
所以平衡常数为:
=276.5,
故答案为:0.4 mol/(L?min);276.5;
③a、增加一种物质的浓度可以提高另一种反应物的转化率,故a正确;
b、催化剂对平衡没有影响,不能改转化率,故b错误;
c、由于该反应前后气体体积不变,所以增大压强,平衡不移动,不能改变甲烷的转化率,故c错误;
故答案为:a;
(3)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系,在400℃时,N
2(g)+3H
2(g)?2NH
3(g)的K′=0.5,
则2NH
3(g)?N
2(g)+3H
2(g)的K=
=2,
故答案为:2;
②测得N
2、H
2、NH
3的物质的量分别为2mol、1mol、2mol,容器容积为0.5,则N
2、H
2、NH
3的物质的量浓度分别为:4mol/L、2mol/L、4mol/L时,Qc
=0.5,Q
C=K,所以该状态是平衡状态,正逆反应速率相等,
故答案为:=;
(4)根据溶液中电荷守恒,c(NH
4+)=c(Cl
-),则c(H
+)=c(OH
-),则溶液显中性,当a=0.1时,两溶液恰好反应生成氯化铵,溶液显示酸性,若要满足溶液显示中性,则加入的氨水应该稍过量,则a>0.1;
溶液中c(NH
4+)=c(Cl
-)=
×0.1mol?L
-1=0.05mol?L
-1,c(H
+)=c(OH
-)=1×10
-7 mol?L
-1(因为是25℃下且为中性),故混合后溶液中c(NH
3.H
2O)=
×amol?L
-1-0.05mol?L
-1=(0.5a-0.05)mol/L,NH
3?H
2O的电离常数K
b=
mol/L=
mol/L,
故答案为:>;
.