
| A. | 维生素C与“金施尔康”都是氧化剂 | |
| B. | 维生素C与“金施尔康”都是还原剂 | |
| C. | 维生素C是氧化剂,“金施尔康”是还原剂 | |
| D. | 维生素C是还原剂,“金施尔康”是氧化剂 |
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,22.4LSO2中含有的原子数为3NA | |
| B. | 1 mol S2-中的电子数为18NA | |
| C. | 7.8gNa2O2加入足量的水中,转移的电子数为0.2NA | |
| D. | 在标准状况下,各为l mol的二氧化硫、CCl4的体积均约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌层破损后即对镀锌铁(白铁)制品失去保护作用 | |
| B. | 制备氢氧化铁胶体时,应向FeCl3溶液中滴加NaOH溶液,并继续煮沸至液体呈红褐色 | |
| C. | 用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘 | |
| D. | 用灼烧闻气味的方法可以区别棉花和羊毛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
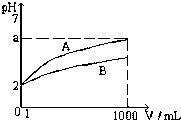 T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示
T℃时,pH=2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O | |
| B. | 稀盐酸除铁锈:6H++Fe2O3=2Fe3++3H2O | |
| C. | 金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol O3的质量为16 g | B. | 32 g O2中含有的氧分子数为2NA | ||
| C. | 1 g H2中含有电子数为1NA | D. | 3.01×1023个铜原子的质量为64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,再充入1molX,该反应的△H变大 | |
| B. | 用Y表示4min内的反应速率为0.1mol/(L•min) | |
| C. | 再向容器中充入1molZ,达到新平衡,n(X):n(Y)=2:1 | |
| D. | 4min后,若升高温度,平衡将向逆反应方向移动,平衡常数K减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com