
| A. | 钠铝合金 | B. | Na2O和Al2O3 | C. | 明矾和BaO | D. | MgO和SO3 |
分析 设物质的量均为1mol,
A.1molNa与水反应生成1molNaOH,与等量的Al发生氧化还原反应生成偏铝酸钠和氢气;
B.1molNa2O与水反应生成2molNaOH,与1molAl2O3反应生成偏铝酸钠和水;
C.1molBaO与水反应生成1molBa(OH)2,与1mol明矾反应,碱不足,生成硫酸钡、氢氧化铝;
D.1molSO3与水反应生成1molH2SO4,与1molMgO反应生成硫酸镁和水.
解答 解:设物质的量均为1mol,
A.1molNa与水反应生成1molNaOH,与等量的Al发生氧化还原反应生成偏铝酸钠和氢气,则溶液为澄清溶液,故A不选;
B.1molNa2O与水反应生成2molNaOH,与1molAl2O3反应生成偏铝酸钠和水,则溶液为澄清溶液,故B不选;
C.1molBaO与水反应生成1molBa(OH)2,与1mol明矾反应,碱不足,生成硫酸钡沉淀、氢氧化铝沉淀,溶液变浑浊,故C选;
D.1molSO3与水反应生成1molH2SO4,与1molMgO反应生成硫酸镁和水,则溶液为澄清溶液,故D不选;
故选C.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意过量判断及物质的量关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度只能改变某一个方向的反应速率 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应体系中混合物的组成保持不变 | |
| D. | 正、逆反应速率相等但不为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ CO32- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
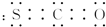 ,其分子呈直线形.
,其分子呈直线形. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氮气所含的原子数为NA | |
| B. | 1mol硫与铁充分反应转移的电子数为2NA | |
| C. | 常温常压下,48gSO3含有的分子数为3NA | |
| D. | 常温常压下,1molNO2气体与水反应生成NA个NO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度相等 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
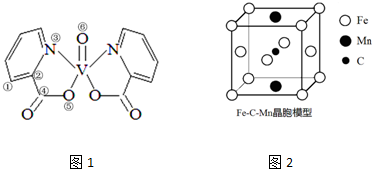
 根据要求回答下列有关问题:
根据要求回答下列有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com