


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:三点一测丛书 高中化学(选修)化学反应原理 江苏版课标本 江苏版课标本 题型:022
25℃时,氢硫酸氢钾溶液里存在着下列平衡:
(a)HS-+H2O![]() OH-+H2S
OH-+H2S
(b)HS-![]() H++S2-
H++S2-
(1)________是电离平衡;________是水解平衡.
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,则电离平衡向________移动;水解平衡向________移动;c(H+)变(填大或小)________;
(3)当向其加入氢氧化钠固体时,c(S2-)变(填“大”或“小”)________.
(4)若将溶液加热至沸腾,c(OH-)·c(H+)将变(“大”或“小”)________.
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省沈阳铁路实验中学高三第一次月考化学试卷(带解析) 题型:填空题
(每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。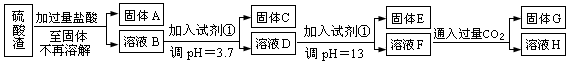
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com