


科目:高中化学 来源: 题型:
| A、71.45KJ |
| B、142.9KJ |
| C、571.6KJ |
| D、285.8KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 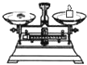 | 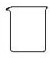 |  |  |  |  |
| 序号 | a | b | c | d | e | f |
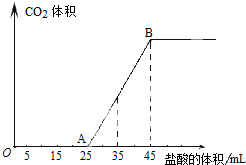
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某钠盐溶液中滴加稀硫酸 | 产生能使石灰水 变浑浊的气体 | 该溶液一定含有SO32-或HCO3- |
| B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
| C | 向Na2S溶液中滴加盐酸 | 产生臭鸡蛋味的气体 | 氯的非金属性比硫的强 |
| D | CO还原Fe2O3得到黑色固体加入盐酸溶解后,再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三者对应的氧化物均为酸性氧化物 |
| B、加热条件下,浓硝酸可与碳、硫单质发生反应 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,向饱和AgCl水溶液中加入盐酸,Ksp值变小 |
| B、25℃时,向CaCO3饱和溶液通入CO2,有沉淀生成 |
| C、25℃时,向CaCl2溶液中通入SO2,有白色沉淀生成 |
| D、25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶上标有温度、浓度、容积和压强 |
| B、如果容量瓶内有少量蒸馏水,必须先对容量瓶进行烘干 |
| C、将所需的氢氧化钠固体倒入到容量瓶中溶解 |
| D、定容时若俯视刻度线观察液面,会使所配制的NaOH 溶液的浓度偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com