
【题目】
(1)第一电离能介于B、N之间的第二周期元素有种.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为。
(3)Fe3C晶体中碳元素为-3价,则其中基态铁离子的电子排布式为。
(4)甲醇(CH3OH)分子内的O-C-H键角(填“大于”、“等于”或“小于”)甲醛(H2C=O)分子内的O-C-H键角。
(5)BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是。
(6)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线吸收法可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 ![]() =(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
=(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
【答案】
(1)3
(2)C>H>Si
(3)[Ar]3d64s1
(4)小于
(5))BF3中B的杂化类型为sp2 , 形成3个共用电子对,无孤对电子,为平面三角形;NF3中N的杂化类型为sp3 , 形成3个共用电子对,还有一对孤对电子,因而为三角锥形
(6)3;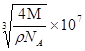
【解析】(1) 同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第V族元素原子最外层电子处于该轨道的全充满、半充满的稳定状态,所以其第一电离能大于其相邻元素,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)元素的非金属性越强,形成共价键时共用电子对就偏向哪种原子,该元素表现的化合价就是负价,CH4中共用电子对偏向C,则非金属性C>H;SiH4中硅元素为+4价,则非金属性H>Si,元素的非金属性越强,元素的电负性就越大,因此C、Si、H的电负性由大到小的顺序为C>H>Si;
(3) Fe3C晶体中碳元素为-3价,则Fe是+1价,Fe是26号元素,基态铁离子Fe+核外有25个电子,电子排布式为[Ar]3d64s1;
(4) 甲醇分子内C原子的杂化方式为sp3 杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2 杂化,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角;
(5)BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是BF3中B的杂化类型为sp2 , 形成3个共用电子对,无孤对电子,为平面三角形;NF3中N的杂化类型为sp3 , 形成3个共用电子对,还有一对孤对电子,因而为三角锥形;
(6) Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之相邻的Kr原子处于面心,每个顶点点Kr原子为8个晶胞共有,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有 (3×8)÷2=12,晶胞中含Kr原子为8×1/8+6×1/2=4,则m:n=12:4=3;已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则根据晶体密度计算公式可知: ![]() ,则表示Kr晶胞参数a=
,则表示Kr晶胞参数a= 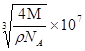 nm。
nm。


科目:高中化学 来源: 题型:
【题目】牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图: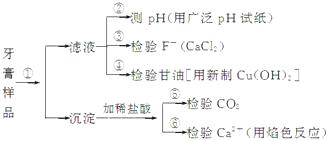
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 , 所需要的主要玻璃仪器有。
(2)在②中用pH试纸测溶液的pH的操作方法是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | NaCl | SO2 |
B | CO2 | NaOH | NaCl | Na2CO3 |
C | HCl | NaOH | CaF2 | CH3COOH |
D | HNO3 | KOH | CaCO3 | CaO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLHCl完全溶于水得到VmL盐酸,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为CmolL。下列叙述中错误的是
A. 可利用CCl4和水吸收HCl,且能防倒吸
B. ω=![]() ×100%
×100%
C. c= ![]() mol/L
mol/L
D. 上述溶液中再加入VmL水,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
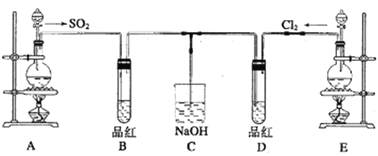
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.通常情况下,甲烷跟强酸、强碱、强氧化剂都不反应
B.甲烷化学性质比较稳定,不能被任何氧化剂氧化
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4 , 都属于取代反应
D.甲烷的四种取代物都难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程图如下: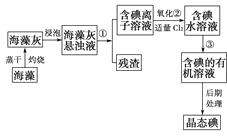
(1)指出提取碘的过程中有关的实验操作名称:
① , ③。
写出过程②中有关反应的离子方程式:。
(2)提取碘的过程中,可供选择的有机溶剂是( )(填序号)。
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是。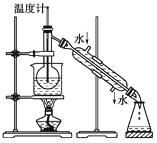
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①;
②;
③。
(5)进行上述蒸馏操作时,使用水浴的原因是 , 最后晶体碘在里聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com