
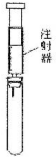
| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
分析 A.酚酞遇碱变红;
B.高锰酸钾与乙烯发生氧化反应;
C.CO2与NaOH反应的产物,若生成碳酸钠与NaOH不反应,若生成碳酸氢钠与NaOH反应生成碳酸钠和水;
D.二氧化硫与氢硫酸反应生成S和水.
解答 解:A.酚酞遇碱变红,则试管中盛酚酞试液,注射器中为氨水,可验证氨气的水溶液呈碱性,故A正确;
B.高锰酸钾与乙烯发生氧化反应,则试管中盛酸性高锰酸钾溶液,注射器中为乙烯,可探究乙烯的还原性,故B正确;
C.CO2与NaOH反应的产物,若生成碳酸钠与NaOH不反应,若生成碳酸氢钠与NaOH反应生成碳酸钠和水,现象均不明显,图中装置不能验证CO2与NaOH反应的产物,故C错误;
D.二氧化硫与氢硫酸反应生成S和水,则试管中盛氢硫酸,注射器中为二氧化硫,可验证SO2的氧化性,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
| A. | 溶液中水电离出的OHˉ个数:①<② | |
| B. | 溶液中分子的微粒数:H2SO3<H2CO3 | |
| C. | 溶液①中:c(Na+)>c(HCO3-)>c(OHˉ)>c(CO32-)>c(H+) | |
| D. | 溶液②中:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L BaCl2溶液中含Cl-数目为0.2NA | |
| B. | 2.8gN2和CO的混合气体中含原子数目0.2NA | |
| C. | 5.6gFe在足量氯气中燃烧,转移电子数目0.2NA | |
| D. | 标况下2.24LCH3COOH中含碳原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐中添加的是碘化钾 | |
| B. | 将甲醛稀溶液喷在白菜上可以保鲜 | |
| C. | 牛奶中掺入三聚氰胺可以提高蛋白质含量 | |
| D. | 人体中维持血液的pH值稳定的主要离子是HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
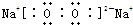 ,Na2O2中的化学键类型有离子键和非极性共价键;
,Na2O2中的化学键类型有离子键和非极性共价键;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com