
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.一定有C1—离子 D.不能确定HCO3-离子是否存在
科目:高中化学 来源: 题型:
| (c+d) | 2 |




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液中肯定不含Fe2+、Mg2+、SiO32- | B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | C、原溶液中肯定含有K+、Fe2+、NO3-、SO42-、I- | D、为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷 题型:填空题
(10分)A~H有如图所示的转化关系,其中A是盐,B、C、D、E、F在常温常压下均是气态物质,反应④、⑤均在溶液中进行,转化中反应条件略去。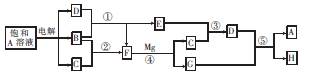
试回答下列问题:
(1)物质A的化学式为 ,电解时阴极反应式为 .
(2)反应③的化学方程式为 。
(3)反应⑤的离子方程式为 。
(4)镁与铝能形成多种合金,为了确定某合金样品的成分,小明同学设计如图所示的实验步 骤,确定合金组成。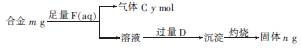
①能确定合金组成的数据组有 (填字母)。
a.m、n b.m、y c.n、y
②若合金中Mg的物质的量分数为x,金属总物质的量为7 mol,试在图中作出y随x变化的曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com