
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:填空题
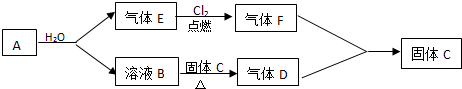
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(X)=2v正(Y) | |
| B. | 单位时间内生成1 mol Y的同时生成2molX | |
| C. | 混合气体的密度不再变化 | |
| D. | 反应容器中Y的质量分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
| A. | 0.1mol•L-1的HA溶液中由水电离出的c(H+)>1×10-13mol/L | |
| B. | c1一定大于0.2 mol•L-1 | |
| C. | 甲反应后的溶液中:HA占含A-微粒总数的0.01% | |
| D. | 乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
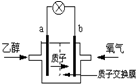 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | 电池工作时,1mol乙醇被氧化时就有6mol电子转移 | |
| B. | a极为电池的负极 | |
| C. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| D. | 电池正极的电极反应为:4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com