
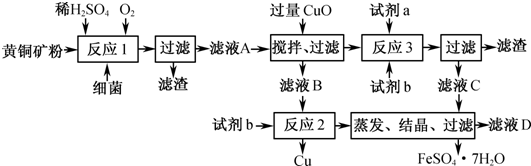
| ||
| ||
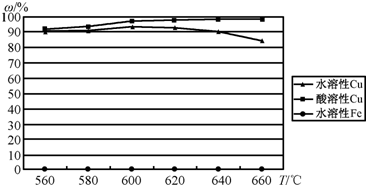
| ||
| ||


科目:高中化学 来源: 题型:
(2011?南京一模)下列实验操作、实验现象及解释与结论都正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
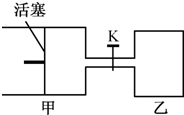 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. |
| ② | 取少量滤液,滴加KSCN溶液,不显红色 取少量滤液,滴加KSCN溶液,不显红色 |
| ③ | 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 |
| ④ | 取上述褪色后的溶液,滴加KSCN溶液显红色 取上述褪色后的溶液,滴加KSCN溶液显红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com