
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,2.24LCCl4含有的共价键数为0.42NA
B. 氢原子数为0.4NA的甲醇分子中含有的键数为0.4NA
C. 1![]() Fe溶于过量硝酸,电子转移数为2NA
Fe溶于过量硝酸,电子转移数为2NA
D. 14![]() 乙烯和丙烯混合气体中的氢原子数为2NA
乙烯和丙烯混合气体中的氢原子数为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列六种有机物:①硝基苯、②苯、③溴苯、④乙酸、⑤乙醇、⑥乙酸乙酯,其中难溶于水且比水轻的含氧有机物是
A. ②④⑥B. ①②③C. ⑤和⑥D. 只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质递变情况错误的是
A. Li、Be、B原子最外层电子数逐渐增多 B. N、O、F原子半径依次增大
C. P、S、C1最高正价依次升高 D. Li、Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由ⅢA、VA族元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为__________(填离子符号)。
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N原子的轨道杂化类型为________________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为____________;BH4-的立体构型是_______;该制备反应的化学方程式为______________。
(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
A.氨硼烷中存在配位键
B.第一电离能大小关系:N>O>C>B>H
C.反应前后碳原子的杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体型、V型、直线型
(3)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为_____________。Ga的配位原子(As)数目为________;Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGacm和rAscm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现__________色和__________色交替的现象。
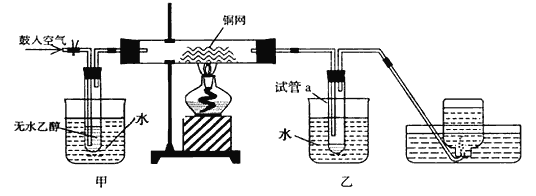
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水。他们的作用依次为______________,________________。
(3)反应进行一段时间后,试管a中能 收集到若干种物质,其中一种液体能使紫色石蕊试纸显红色, 要除去该物质,可在混合液中加入_____________(填写字母)除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E;C又可以转化为B、A。它们的转化关系如下:
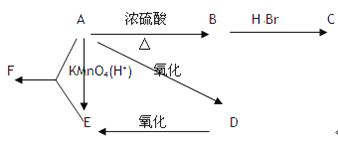
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、C、D、F的名称
A _________ ;C _________ ; D _________ ;F _________ 。
(2)指出实现下列转化的反应类型
C→A ____________ ;D→A ____________ ;C→B ____________ ;
(3)写出实现下列转化的化学方程式
A→B ___________________________ ;B→C _____________________________ ;
A→D ___________________________ ;A+E→F ___________________________ ;
D发生银镜反应 ____________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com