
【题目】下列有关苯 (![]() ) 与(3)-轴烯 (
) 与(3)-轴烯 (![]() )的说法错误的是
)的说法错误的是
A.二者互为同分异构体
B.二者可用酸性KMnO4溶液鉴别
C.(3)-轴烯与足量H2反应所得产物的二氯代物有5种
D.苯分子中所有原子共平面,(3)-轴烯分子中所有原子不可能共平面
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。W、X、Y、Z均为短周期元素,原子序数依次增加,其中W、X、Z组成的化合物M、N、R之间存在如图所示的反应。下列叙述正确的是
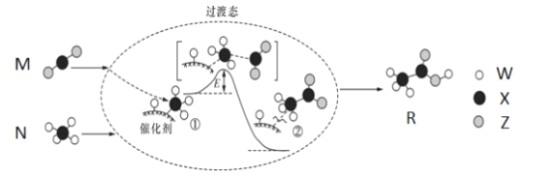
A.元素非金属性的顺序为X>Y>Z>W
B.M、N、R三种分子中,所有原子均满足8电子稳定结构
C.M、N、R三种分子均含有极性键和非极性键
D.W、X、Y、Z四种元素既可形成离子化合物,又可形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。在1LHA和HB的溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
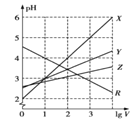
A.X是HA,Y是HB
B.常温下pH:NaA溶液>NaB溶液
C.若常温下,浓度均为0.1mol/L的NaA和HA的混合溶液pH>7,则c(A-)>c(HA)
D.在等浓度的NaA和NaB混合溶液中通入HCl至中性时,c(Cl-)=c(HA)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置。写出A中发生反应的方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | _________ | _________ |
D | _________ | _________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________。
(4)某课外小组为了验证Na2CO3和NaHCO3的稳定性,设计了如图所示的实验装置,你认为在试管B中应放的物质是_______,C、D两个烧杯中的溶液分别是______、_______,Na2CO3粉末中混有少量NaHCO3,除去杂质的方法(写方程式)________。
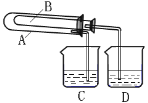
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCCl4中含原子总数为5NA
B.物质的量浓度为0.5![]() MgCl2溶液中,含有Cl—数目为NA
MgCl2溶液中,含有Cl—数目为NA
C.常温常压下,NA个CO2分子占的体积大于22.4L
D.3.2g由氧气和臭氧组成的混合物中含有氧气分子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.10molL1-1YOH溶液中逐渐滴加0.20molL-1HX 溶液,混合溶液的pH 变化如图所示(温度和体积变化忽硌不计)。下列结论错误的是
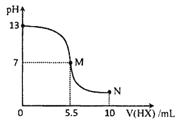
A.HX为一元弱酸,YOH 为一元强碱
B.M点对应溶液中水的电离程度大于N 点溶液中水的电离程度
C.N点对应溶液中粒子浓度:c(HX)> c(X - ) > c(Y+ ) > c(H+ ) > c(OH-)
D.室温时,pH = a 的YX溶液中水电离出的c(OH-)=l.0×10-(14-a)molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列8种化学符号:![]() O2、
O2、![]() O3、
O3、![]() H、
H、![]() C、
C、![]() Na、
Na、![]() N、
N、![]() C、
C、![]() Mg。
Mg。
(1)表示核素的符号共_____种。
(2)互为同位素的是______,质量数相等的是_______,中子数相等的是____。
(3)质量相同的H216O和D216O所含中子数之比为________。
Ⅱ.根据周期表对角线规则,金属Be与Al的单质及其化合物的性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式____________
(5)Be(OH)2与Mg(OH)2可用_________鉴别。
Ⅲ.铜有两种天然同位素 ![]() Cu和
Cu和![]() Cu,参考铜的相对原子质量(63.5)。
Cu,参考铜的相对原子质量(63.5)。
(6)计算![]() Cu的质量百分含量约是_________。(保留3位有效数字)
Cu的质量百分含量约是_________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸HX是一元弱酸,25℃时的电离平衡常数K a= 4.0×10—8。
(1)写出该酸的电离方程式_____________,其电离平衡常数表达式K a =_______。
(2)25℃时,向1 mol·L-1 HX 溶液中加入1 mol·L-1 盐酸,会________(“抑制”或“促进”)HX的电离,c(H+)____________(填“增大”、“减小”或“不变”), 电离平衡常数K a ________(填“增大”、“减小”或“不变”)。
(3)25℃时,若HX的起始浓度为0.01 mol·L-1,则平衡时c(H+)=_________mol/L, 由水电离的出的c(H+)=___________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com