
分析 氧化还原反应中,得电子化合价降低的反应物是氧化剂,对应产物是还原产物,失电子化合价升高的反应物是还原剂,对应产物是氧化产物,根据元素化合价变化计算转移电子数.
解答 解:反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂,具有还原性,被氧化得到氧化产物为Cu(NO3)2;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂,具有氧化性,被还原得到还原产物为NO2;其得失电子数为2,所以其转移电子数为2,即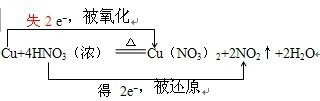 ;
;
故答案为: ;HNO3;Cu; Cu(NO3)2; NO2;HNO3和Cu(NO3)2;Cu和NO2.
;HNO3;Cu; Cu(NO3)2; NO2;HNO3和Cu(NO3)2;Cu和NO2.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 室温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液所得的滴定曲线如图(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:
室温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液所得的滴定曲线如图(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) | |
| B. | V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)=0时,c(H+)=1×10-2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 皮肤上沾有浓碱溶液时,立即用酒精冲洗 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 正反应是放热反应a>b | B. | 正反应是吸热反应a<b | ||
| C. | 正反应是吸热反应a>b | D. | 正反应是放热反应a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、固态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙加到醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 浓烧碱与铝片反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 铜片插入盐酸中:2H++Cu=Cu2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com