
| A. | 晶体中不存在独立的“分子” | |
| B. | 含有1 mol C的金刚石中,形成的共价键有2 mol | |
| C. | 是自然界中硬度最大的物质 | |
| D. | 化学性质稳定,即使在高温下也不会与氧气发生反应 |
分析 A.金刚石是原子晶体,是由原子构成的;
B.碳最外层4个电子,而形成一个价键需2个电子,所以有1 mol C的金刚石中,形成的共价键有2 mol;
C.原子晶体硬度较大;
D.C单质在常温下较稳定,但高温下能与氧气反应生成碳的氧化物.
解答 解:A.金刚石是原子晶体,是由原子构成的,所以晶体中不存在独立的“分子”,故A正确;
B.碳最外层4个电子,而形成一个价键需2个电子,所以有1 mol C的金刚石中,形成的共价键有2 mol,故B正确;
C.原子晶体硬度较大,金刚石是原子晶体,其硬度较大,故C正确;
D.C原子最外层有4个电子,不易得电子也不易失电子,所以其单质在常温下较稳定,但高温下能与氧气反应生成碳的氧化物,故D错误;
故选D.
点评 本题考查金刚石组成、结构及其性质,为高频考点,以金刚石为例熟练掌握原子晶体构成微粒、晶胞结构,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
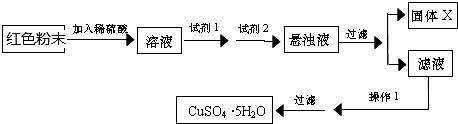
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
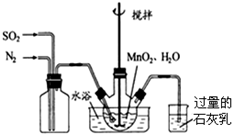
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切 | |
| D. | 称取Na2CO3固体时,采用了“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色NO 2加压后颜色先变深后变浅 2NO2?N2O4 | |
| B. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| C. | SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 | |
| D. | H2、I2、HI平衡混合气体加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com