
现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、AlO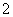 、NO
、NO 、SO
、SO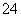 、CO
、CO 。将它们分别配成0.1 mol·L-1的溶液进行如下实验:
。将它们分别配成0.1 mol·L-1的溶液进行如下实验:
①测得A、C、E溶液均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;④向D溶液中滴加Ba(NO3)2溶液,无明显现象。
(1)写出A、D、E、F的化学式:
A.________;D.________;E.________;F.________。
(2)用离子方程式解释C溶液呈碱性的原因: __________________ _________________________。
(3)写出实验③中反应的离子方程式: ____________________________ __________________。
解析 使溶液呈碱性的阴离子有OH-、AlO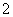 、CO
、CO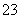 。根据实验②可以确定B为AgNO3,根据实验③可以确定F可能为FeCl2或者FeSO4,根据实验④可以确定D中不可能含有SO
。根据实验②可以确定B为AgNO3,根据实验③可以确定F可能为FeCl2或者FeSO4,根据实验④可以确定D中不可能含有SO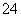 ,所以F为FeSO4,D为AlCl3。由于氢氧化铝的酸性小于碳酸氢根的,所以偏铝酸盐的碱性强于碳酸盐的,结合碱性A>E>C,可以确定A为Ba(OH)2,E为KAlO2,C为Na2CO3。C溶液呈碱性的原因:CO
,所以F为FeSO4,D为AlCl3。由于氢氧化铝的酸性小于碳酸氢根的,所以偏铝酸盐的碱性强于碳酸盐的,结合碱性A>E>C,可以确定A为Ba(OH)2,E为KAlO2,C为Na2CO3。C溶液呈碱性的原因:CO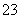 +H2OHCO
+H2OHCO +OH-。实验③中反应的离子方程式为3Fe2++NO
+OH-。实验③中反应的离子方程式为3Fe2++NO +4H+===3Fe3++NO↑+2H2O。
+4H+===3Fe3++NO↑+2H2O。
答案 (1)Ba(OH)2 AlCl3 KAlO2 FeSO4
(2)CO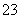 +H2OHCO
+H2OHCO +OH-
+OH-
(3)3Fe2++NO +4H+===3Fe3++NO↑+2H2O
+4H+===3Fe3++NO↑+2H2O


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.H2O在高温下难分解,H2S在300 ℃即分解,说明氧的非金属性比硫强
B.H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强
C.I-的还原性比Br-强,由此可推断溴的非金属性比碘强
D.已知反应:2NH3+3Cl2===N2+6HCl,由此可推断非金属性氯强于氮
查看答案和解析>>
科目:高中化学 来源: 题型:
作为世界卫生组织(WHO)推荐的Al级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)反应时,ClO2生成ClO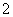 、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为________。
、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为________。
2亚氯酸根离子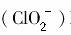 对人体不利。欲在弱碱性条件下将水中的
对人体不利。欲在弱碱性条件下将水中的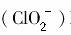 转化为Cl-除去,若该反应体系中的物质有:NaClO2、FeOH3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目。
转化为Cl-除去,若该反应体系中的物质有:NaClO2、FeOH3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目。

查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有I-、NH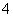 、Cu2+、SO
、Cu2+、SO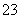 ,向溶液中加入足量的溴水,反应后溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
,向溶液中加入足量的溴水,反应后溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO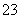 ④可能含有I-
④可能含有I-
A.①② B.①③
C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
能在无色水溶液中大量共存的一组离子是( )
A.H+、Fe3+、I-、Cl-
B.Al3+、Mg2+、NO 、Cl-
、Cl-
C.K+、Ag+、Ca2+、CO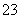
D.NH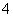 、Na+、AlO
、Na+、AlO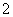 、MnO
、MnO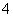
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式不准确的是( )
A.用浓盐酸检验氨:NH3+HCl===NH4Cl
B.碳酸钠溶液显碱性:CO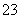 +H2OHCO
+H2OHCO +OH-
+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法中正确的是(双选)( )
A.100 mL 1 mol·L-1 Na2CO3溶液中溶质离子的总数小于0.3NA
B.若120 g的墨粉(只含碳)能打a个字,则平均每个字约含有10NA/a个碳原子
C.25℃、101 kPa时,0.1NA个H2分子完全燃烧生成液态水,放出a kJ热量,表示氢气燃烧热的热化学方程式为H2(g)+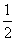 O2(g)===H2O(l) ΔH=+10a kJ·mol-1
O2(g)===H2O(l) ΔH=+10a kJ·mol-1
D.常温下28 g 14CO中含有14NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)  qZ(g) ΔH>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g) ΔH>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.升高温度,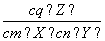 增大
增大
B.降低温度,混合气体的平均相对分子质量增大
C.通入稀有气体,压强增大,平衡向正反应方向移动
D.X的正反应速率是Y的逆反应速率的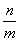 倍
倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com