
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
分析 A.根据硫酸氢钠溶液中的电荷守恒和物料守恒分析;
B.氯化银的溶解度大于碘化银,则氯离子浓度大于碘离子;
C.碳酸的电离分步进行,以第一步为主,则碳酸氢根离子浓度大于碳酸根离子;
D.根据物料守恒分析.
解答 解:A.根据电荷守恒,pH=1的NaHSO4溶液存在:c(Na+)+c(H+)=2c(SO42-)+c(OH-),因为c(Na+)=c(SO42-),所以c(H+)=c(SO42-)+c(OH-),故A正确;
B.含有AgCl和AgI固体的悬浊液,碘化银的溶解度小于氯化银,则氯离子浓度大于碘离子,溶液中离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故B错误;
C.H2CO3的第一步电离大于第二步电离,则c(H+)>c(HCO3-)>c(CO32-)>c(OH-),故C错误;
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)═3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D错误;
故选A.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡应用、弱电解质的电离等知识,题目难度中等,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒的含义,明确难溶物溶解平衡及其应用方法.


科目:高中化学 来源: 题型:选择题
 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )| A. | 作用时电子由Zn极经外电路流向Ag2O极,Zn是负极 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极 | |
| C. | 正极的电极反应为Ag2O+2e-+H2O═2Ag+2OH- | |
| D. | Zn极发生氧化反应,Ag2O极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 高温、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6 NA个 | |
| C. | 25℃时,1L0.1mol•L-1FeCl3溶液中含有0.1 NA 个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
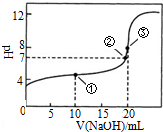 常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定 20.00mL1000mol•L-1CH3COOH溶液滴定曲线如图.下说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 点①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点③所示溶液中:c(CH3COO-)>c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com