
活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用,下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:
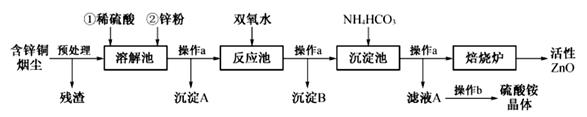
已知:①含锌铜烟尘经过预处理后的主要成分是ZnO,还含有少量的CuO和Fe2O3
②反应池中的温度控制在90~95℃,反应池中所发生反应的离子方程式为
2Fe2++H2O2+4H2O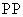 2Fe(OH)3↓+4H+
2Fe(OH)3↓+4H+
试回答下列问题:
(1)在实验室中,进行操作a用到的主要玻璃仪器有:烧杯、 、 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;
② ;
③调节溶液的pH。
(3)检验溶解池中Fe2+已全部被还原为Fe2+的实验方法是 。
(4)沉淀池中得到的沉淀化学式可以表示为aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。
某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,
将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,
通过计算确定该沉淀的组成。(写出计算过程)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
科学家正在研究开发新的能源。“绿色能源”目前是研究的新能源之一,高粱、玉米等植物的种子经发酵、蒸馏就可以得到一种“绿色能源”物质。这种物质是
A..氢气 B.甲烷 C.酒精 D.木炭
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)石墨是层状结构,如下图所示。每一层内的碳原子间通过sp2杂化形成 (填代号字母,后同);层与层间存在 ;石墨的每一个碳原子经过sp2杂化后,还剩下1个未成对电子,在电场作用下能够作定向移动,因而石墨还具有导电性,所以还存在 。
a:σ键 b:π键 c:氢键 d:配位键
e:范德华力 f:金属键 g:离子键
(2)请选“>”、“<”或“=”填与下列空格中:
①熔点:Na Mg;②硬度:金刚石 晶体硅;③晶格能:NaI NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的化学方程式正确的是
A.工业制酒精:CH2=CH2+H2O  CH3CH2OH
CH3CH2OH
B.乙醇催化氧化:CH3CH2OH 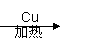 CH3CHO+H2
CH3CHO+H2
C.实验室制乙酸乙酯:CH3COOH +CH3CH2OH 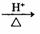
CH3COOCH2CH3
D.合成聚乙烯塑料:
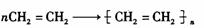
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,关于溶液的下列说法正确的是
A.c(H+):c(OH-)=1:1 0-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在
0-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在
B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在
C. 往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中 增大
增大
D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中
c(CO32-)的大小关系为:②>④>③>⑤>①
查看答案和解析>>
科目:高中化学 来源: 题型:
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
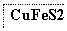
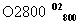
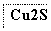
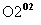
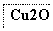
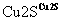
 ―→
―→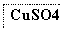
(1)基态铜原子的外围电子排布式为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
 (2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液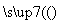 蓝色沉淀
蓝色沉淀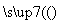 沉淀溶解,得
沉淀溶解,得
到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离
子方程式_______________________;深蓝色透明
溶液中的阳离子(不考虑H+)内存在的全部化学
键类型有 。
(4) 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Cu2+的溶液中加入铁粉,充分反应后,固体残渣用盐酸处理有气体放出,则与铁粉反应后的溶液中离子最多的是( )
A.Fe3+ B.Fe2+ C.Cu2+ D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d、e五种气体,现进行下列实验:
| (1)a和b混合 | 气体变红棕色 |
| (2)c和d混合 | 产生白烟 |
| (3)c和e分别通入少量溴水中 | 溴水都变成无色透明的液体 |
| (4)b和e分别通入氢硫酸中 | 都产生淡黄色浑浊 |
则a、b、c、d、e依次可能是( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com