
| A. | 常温常压下,1mol21H2含有nA个质子 | |
| B. | 1molCu与足量FeCl3溶液充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4L甲醇含有nA个分子 |
分析 A.氢气分子中含有2个质子,1mol氢气中含有2mol质子;
B.铜与铁离子反应生成铜离子和亚铁离子,1mol铜完全反应失去2mol电子;
C.硫酸溶液中,硫酸和水分子中都含有氢原子,漏掉了水中氢离子;
D.标准状况下,甲醇的状态不是气体.
解答 解:A.1mol21H2含有2molH原子,含有的质子为2mol,含有2nA个质子,故A错误;
B.1mol铜与氯化铁溶液完全反应失去2mol电子,充分反应转移了2nA个电子,故B正确;
C.49g硫酸的物质的量为:$\frac{49g}{98g/mol}$=0.5mol,0.5mol硫酸中含有1mol氢离子,由于溶液中的水分子也含有H原子,则溶液中含有的氢原子数目大于nA,故C错误;
D.标况下甲醇不是气体,不能使用标况下的气体摩尔体积计算据此的物质的量,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题培养了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
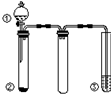 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓盐酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 浓硫酸 | 蔗糖 | 酸性KMnO4溶液 | 浓硫酸具有酸性、脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应2Mg(s)+CO2(g)═2MgO(s)+C(s)能自发进行,则该反应的△H<0 | |
| B. | 铅蓄电池放电时反应为:PbO2+Pb+2H2SO4═2PbSO4+H2O,正、负极质量均减小 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,充分搅拌后过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂或操作 | 鉴别方法 |
| A | 点燃 | 观察火焰 |
| B | 酸性高锰酸钾溶液 | 观察溶液颜色变化 |
| C | 水 | 观察水溶液 |
| D | 溴的四氯化碳溶液 | 观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
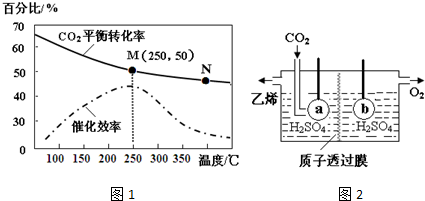
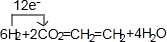 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;其所含化学键类型为共价键、离子键;
;其所含化学键类型为共价键、离子键;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值为3:2:1 | |
| C. | 在2min末的反应速率,用B表示是0.3mol•L-1•min-1 | |
| D. | 在2min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com