
| A. | 36g水中含有的水分子数是2NA | |
| B. | 标准状况下,33.6LCO中含有的原子数是3NA | |
| C. | 0.5L0.2mol/L的NaCl溶液中含有的Na+数是0.1NA | |
| D. | 常温常压下,1molCH4的体积约为22.4L |
分析 A、质量换算物质的量结合阿伏伽德罗常计算分子数;
B、依据气体摩尔体积计算物质的量结合氧气分子式计算微粒数;
C、依据n=Vc计算溶质物质的量结合化学式计算离子数;
D、常温常压下,气体摩尔体积不是22.4L/mol.
解答 解:A、36g水物质的量=$\frac{36g}{18g/mol}$=2mol,含有的水分子数是2NA,故A正确;
B、标准状况下,33.6LCO物质的量$\frac{33.6L}{22.4L/mol}$=1.5mol;含有的原子数是3NA,故B正确;
C、0.5L0.2mol/L的NaCl 溶液中NaCl物质的量=0.5L×0.2mol/l=0.1mol,含有的Na+数是0.1NA,故C正确;
D、常温常压下,1mol甲烷的体积大于22.4L,故D错误,故选D.
点评 本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的体积应用,题目较简单.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3化合反应 | |
| B. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ 分解反应 | |
| C. | CuO+CO═Cu+CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.03 mol/L | C. | 0.05 mol/L | D. | 0.04 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼金属钠通常用电解氯化钠溶液的方法 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 用氯气和氢氧化钠制漂白粉 | |
| D. | 工业冶炼金属铁用铝和三氧化二铁高温下发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
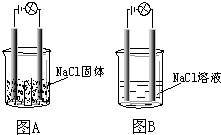 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 在NaCl溶液中,水电离出了大量的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1KI溶液、0.1 mol•L-1稀硫酸外,还需要用到淀粉溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com