
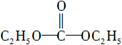 .
.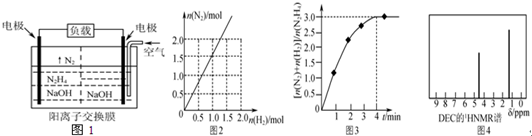
分析 (1)①正极是氧气得电子生成氢氧化根离子,所以正极区NaOH浓度较大;②负极发生氧化反应;
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),两步电离都电离产生氢氧根离子,而第一步电离为主;
(3)根据得失电子守恒配平,其中的水合肼是弱电解质用化学式;
(4)①在高温下,N2H4可完全分解为NH3、N2及H2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(1-x)mol,根据4min时比值为3,求出x的值,然后根v=$\frac{△c}{△t}$计算;
(5)C5H10O3分子中有两种氢,且不饱和度为1,所以碳氧双键高度对称.
解答 解:(1)①正极是氧气得电子发生还原反应,正极反应为:O2+2H2O+4e-=4OH-,生成氢氧化根离子,所以正极区NaOH浓度较大,故答案为:正;
②负极发生氧化反应,肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,电极反应式为:N2H4+4OH--4e-=4H2O+N2↑;
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),两步电离都电离产生氢氧根离子,而第一步电离为主,所以离子的浓度大小为:②OH-、③N2H5+、④N2H52+、①H+,故答案为:②③④①;
(3)根据得失电子守恒配平,其中的水合肼是弱电解质用化学式,所以离子方程式为:2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O,故答案为:2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O;
(4)①在高温下,N2H4可完全分解为NH3、N2及H2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2,故答案为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(0.1-x)mol,根据4min时比值为3,所以$\frac{3x}{0.1-x}$=3,则x=0.05mol,v=$\frac{△c}{△t}$=$\frac{\frac{0.05}{1}}{4}$=0.0125mol•L-1•min-1,故答案为:0.0125mol•L-1•min-1;
(5)C5H10O3分子中有两种氢,且不饱和度为1,所以碳氧双键高度对称,所以结构式为: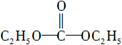 ,故答案为:
,故答案为: .
.
点评 本题考查电极反应式的书写、离子浓度大小的比较、离子方程式的书写、图象问题等,综合性强,但有一定的难度.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
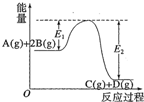
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 | |
| D. | 1molA(g)和2molB(g)充分反应后放热QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | B. | △H3<△H4 | C. | △H5=△H3-△H2 | D. | 2△H5=3△H3-△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质的分子都可以用Cm(H2O)n来表示 | |
| B. | 凡能溶于水具有甜味的物质都属于糖类 | |
| C. | 糖类都能发生水解反应 | |
| D. | 糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com