
 (1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.分析 (1)FeCl3与KClO在强碱性条件下发生氧化还原反应生成高铁酸钾、氯化钾、和水,结合得失电子守恒写出方程式;
K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应;依据产物和电子守恒写出正极反应:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;有正极反应和负极反应合并得到电池反应;
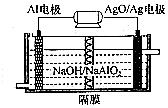
(2)碱性条件下,Al失电子被氧化,电极反应为Al-3e-+4OH-=AlO2-+2H2O,AgO得电子被还原,应为原电池的正极,电极反应式为AgO+2e-+H2O=Ag+2OH-,据此判断.
解答 解:(1)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-;3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(2)碱性条件下,Al失电子被氧化,电极反应为Al-3e-+4OH-=AlO2-+2H2O,AgO得电子被还原,应为原电池的正极,电极反应式为AgO+2e-+H2O=Ag+2OH-,则该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O;
故答案为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
点评 本题考查了氧化还原反应、原电池的工作原理的应用、电极反应式的书写等,题目难度中等,熟悉氧化还原反应的规律、原电池的工作原理是解题关键,注意培养阅读材料获取信息的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: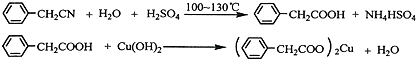
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
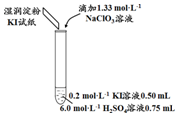 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |
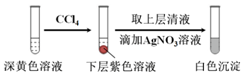
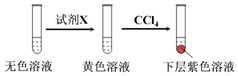
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
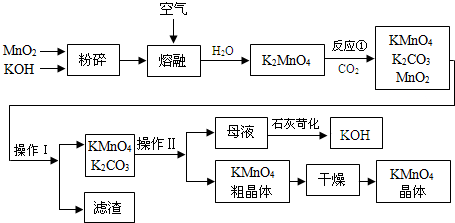

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
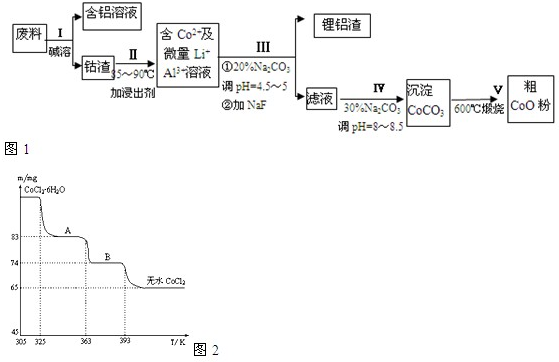
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com