
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| C. | 若升高温度,X的体积分数增大,则该反应的△H>0 | |
| D. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
分析 一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,则
2X(g)+Y(g)?Z(g)
起始量(mol) 1 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
结合反应的特点以及外界条件下对平衡移动的影响解答该题.
解答 解:一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,则
2X(g)+Y(g)?Z(g)
起始量(mol) 1 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
A.增大压强,平衡正向移动,则物质Y的转化率增大,故A错误;
B.以X浓度变化表示的反应速率为$\frac{\frac{0.6mol}{10L}}{60s}$=0.001 mol/(L•s),故B正确;
C.若升高温度,X的体积分数增大,说明平衡逆向移动,则该反应的△H<0,故C错误;
D.将容器体积变为20 L,则体积增大,压强减小,平衡逆向移动,Z的平衡浓度小于原来的$\frac{1}{2}$,故D错误.
故选B.
点评 本题考查化学平衡问题,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,本题注意外界条件对化学平衡的影响,把握反应速率的计算.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量的浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO42-浓度之比为1:1:3 | |
| B. | 将10 mL 1 mol/L H2SO4稀释成0.1 mol/L的H2SO4,可向该溶液中加入100 mL水 | |
| C. | 将1 mol/L的NaCl溶液和0.5 mol/L的BaCl2溶液等体积混合后,不考虑溶液体积变化c(Cl-)=0.75 mol/L | |
| D. | 50 g浓度为c mol/L,密度为ρ g•cm-3的氨水(ρ<1)中加入一定量的水(ρ=1g•cm-3)稀释成0.5c mol/L,则加入水的体积应小于50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
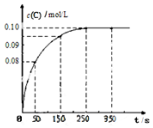 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com