
| 选项 | X溶液 | 固体Y |  |
| A | 浓硫酸 | 铜粉 | |
| B | 浓氨水 | CaO | |
| C | 稀盐酸 | 石灰石 | |
| D | 浓盐酸 | 高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:多选题
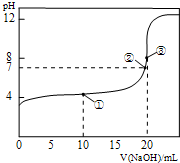 25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )| A. | 点①所示溶液:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 点②所示溶液:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | 点③所示溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定终点时:c(CH3COOH)+c(CH3COO-)=c(Na+ ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜,铁作阴极 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 原电池中电解质溶液中的阳离子向负极移动 | |
| D. | 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质 | |
| D. | 钠与氧气反应的产物与反应条件无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 |
| 溶液的体积/ml | 10.00 | 10.00 | 10.00 |
| 消耗Na2S2O3标准溶液的体积/ml | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫常用于食品漂白 | |
| B. | 碳酸氢钠常用于焙制糕点 | |
| C. | 氢氧化铝可作耐高温材料 | |
| D. | 氧化钠常用作呼吸面具中的氧气来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与足量酸反应:离子方程式相同 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 等物质的量与足量酸反应产生CO2的质量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有第ⅡA族元素的原子最外层有2个电子 | |
| B. | L电子层为奇数的所有元素都是非金属 | |
| C. | 第三、四、五、六周期元素的数目分别是18、18、32、32 | |
| D. | 由左至右第8、9、10三列元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
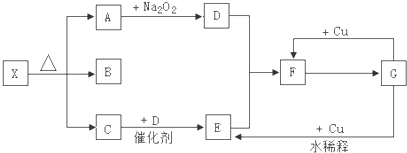
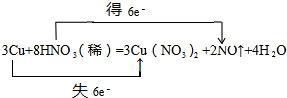 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com