
 实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:
实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:分析 (1)求出所需的碳酸钠的物质的量,然后根据1mol十水碳酸钠能提供1mol碳酸钠,从而可知所需的十水碳酸钠的物质的量和质量;
(2)用量筒读数时,注意它的分度值,视线要与量筒内液体面相平;用量筒量取液体时,量筒要放平,读数时视线应与凹液面最低处相平;根据图示的仪器来分析名称和其用途;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(1)所需的碳酸钠的物质的量n=CV=0.1mol/L×0.5L=0.05mol,而1mol十水碳酸钠能提供1mol碳酸钠,故所需的十水碳酸钠的物质的量为0.05mol,质量m=nM=0.05mol×286g/mol=14.3g;
(2)由图知:量筒A与B之间有五个小格,所以一个小格代表0.2ml,即此量筒的分度值为0.2ml,凹液面最低处与7mL以上一个刻度处相平,所以液体体积为7.2mL;
根据仪器的外形可知,此仪器为容量瓶,由于容量瓶只有一条刻度线,故500mL容量瓶只能配制出500mL即0.5L溶液,故答案为:7.2;容量瓶;0.5;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有:托盘天平、烧杯、玻璃棒、药匙、500mL容量瓶和胶头滴管,故答案为:500mL容量瓶;胶头滴管;
(4)A、加水时越过刻度线,则溶液体积偏大,浓度偏小,故答案为:偏低;
B、容量瓶内壁附有水珠而未干燥处理,对浓度无影响,故答案为:不变;
C、溶解后没有冷却便进行定容,故溶液冷却后体积偏小,故浓度偏高,故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


科目:高中化学 来源: 题型:解答题

实验次数[来源:Zxxk.Com] 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中旧键断裂需吸收能量小于新键形成需放出能量 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量无关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4L HCl 气体溶于水配成1L的盐酸溶液 | |
| C. | 将100mL 10mol/L的浓盐酸加水900mL混合所配成的溶液 | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | FeCl3溶液 | Cu | 浓硝酸 |
| ③ | 氨水 | Al(OH)3 | 稀硫酸 |
| ④ | KOH溶液 | SiO2 | 盐酸 |
| A. | ①② | B. | ①④ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙和铁粉常用作食品干燥剂 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 碳酸钡不溶于水因此在医疗上用作钡餐 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+H2O+NH3↑ | B. | 2H2S+O2═2H2O+2S↓ | ||
| C. | NaH+H2O═NaOH+H2↑ | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
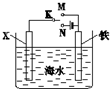
| A. | 若X为Zn时,则开关K置于M或N时均可减缓铁的腐蚀 | |
| B. | 若X为Cu时,为减缓铁的腐蚀,开关K应置于M处 | |
| C. | 若X为石墨、开关K置于M时,X电极上的反应为2H++2e-=H2↑ | |
| D. | 若X为石墨、开关K置于N时,铁电极上的反应为Fe-2e-=Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com