
| |||||||||||||||||||||||||||||||||||||
科目:高中化学 来源: 题型:
![]() +5Cu2S+44H+
+5Cu2S+44H+![]() 10Cu2++5SO2+8Mn2++22H2O
10Cu2++5SO2+8Mn2++22H2O
![]() +5CuS+28H+
+5CuS+28H+![]() 5Cu2++5SO2+6Mn2++14H2O
5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
![]()
![]() +
+![]() Fe2++
Fe2++![]() H+
H+![]()
![]() Mn2++
Mn2++![]() Fe3++
Fe3++![]() H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL0.1 mol·L-1Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=
(4)混合物中Cu2S的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
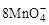 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
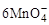 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______![]() +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室欲配制500 mL0.2![]() 的Na2SO4溶液。
的Na2SO4溶液。
(1)通过计算可知,应用托盘天平称量_________克Na2SO4固体。
(2)本实验所需仪器为(填序号)_________,此外还必须添加的仪器为_________。
A、量筒 B、托盘天平和砝码 C、烧杯 D、漏斗
E、250容量瓶 F、500容量瓶 G、药匙 H、胶头滴管 I、坩埚
(3)从下面选出所需的操作并写出正确的顺序_________。
A、洗涤 B、干燥 C、量取 D、称量 E、定容 F、转移溶液
G、稀释 H、溶解
(4)在使用容量瓶之前必须进行的操作是___________________________。
(5)在实验过程中出现如下情况应如何处理?
①加蒸馏水不慎超过了刻度____________________________________
②加蒸馏水离刻度线约1~2cm处时应__________________________
③俯视观察到液面刚好到达刻度线,应_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com