
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K增大 |
分析 A.由图可知,反应至10分钟达到平衡状态,△c(CO)=1mol/L-0.25mol/L,△c(CH3OH)=0.75mol/L-0=0.75mol/L,△c(CO):△c(CH3OH)=1:1,配平氢气即可;
B.反应进行至3分钟时,并没有达到化学平衡状态;
C.反应至10分钟时,△c(CO)=1mol/L-0.25mol/L,带入v=$\frac{△c}{△t}$计算;
D.增大压强,平衡向气体体积减小的方向移动,K不变.
解答 解:A.由图可知,反应至10分钟达到平衡状态,△c(CO)=1mol/L-0.25mol/L=0.75mol/L,△c(CH3OH)=0.75mol/L-0=0.75mol/L,△c(CO):△c(CH3OH)=1:1,反应的化学方程式:CO+2H2?CH3OH,故A正确;
B.反应进行至3分钟时,并没有达到化学平衡状态,因此正、逆反应速率不相等,故B错误;
C.反应至10分钟时,△c(CO)=1mol/L-0.25mol/L=0.75mol/L,v(CO)=$\frac{0.75mol/L}{10min}$=0.075 mol/(L•min),故C正确;
D.增大压强,平衡向气体体积减小的方向移动,K只受温度的影响,K不变,故D错误;
故选BD.
点评 本条考查了化学平衡的建立过程,侧重于化学反应速率的计算、平衡状态的判定和平衡移动,难度不大,其中B、D为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 溶液为浅绿色 | |
| B. | 溶液为棕黄色 | |
| C. | 加入硫氰化钾溶液显红色 | |
| D. | 滴加NaOH溶液,产生白色沉淀,该沉淀放置在空气中不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
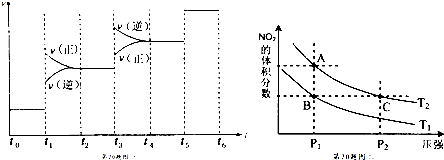
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
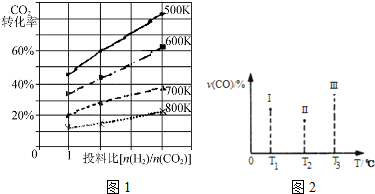
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJmor-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+202 (g)═C02 (g)+2H20(g)△H=-890.3kJ mol-1 | |
| B. | 500 V、30MPa下,将0.5molN2和1.5 molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2 (g)$?_{500℃、30Mp}^{催化剂}$2NH3(g)△H=-38.6 kJmol-1 | |
| C. | 同温同压下,等物质的量的H2与足量的C12在光照和点燃条件下充分反应,所产生的热量相同 | |
| D. | 已知中和热为57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为 2H+(aq)+SO42-(aq)+Ba2+(aq)+20H-(aq)=BaS04 (s)+2H20(l)△H=-57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
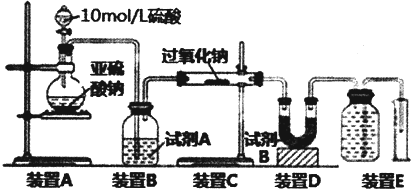
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
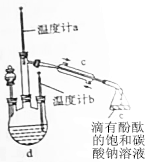 乙酸丁酯沸点、溶解性如下表.
乙酸丁酯沸点、溶解性如下表.| 物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 90%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com