
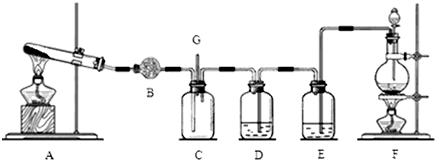
分析 装置A制取氨气,可用氯化铵与熟石灰反应制取,氨气是碱性气体,要除去水蒸气只能用碱性物质,B装置中盛放的碱石灰,用来干燥氨气;装置F制取氯气,从F中制得的氯气含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水的E和盛有浓硫酸的D除去,装置C中氨气与HCl反应生成氯化铵.
(1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气,装置F中浓盐酸与二氧化锰发生反应生成二氯化锰、氯气与水;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,先用饱和食盐水除去HCl,再用浓硫酸除去水蒸气;
(3)装置A是用固体氯化铵和固体氢氧化钙加热制备氨气;
(4)计算氯化铵的物质的量,根据N原子守恒计算氨气物质的量,再根据V=nVm计算氨气体积;
(5)装置C中有白烟产生,是由于氨气与HCl反应生成氯化铵;
(6)氯气能与氢氧化钠溶液反应,用氢氧化钠溶液吸收过量的氯气,防止污染空气.
解答 解:装置A制取氨气,可用氯化铵与熟石灰反应制取,氨气是碱性气体,要除去水蒸气只能用碱性物质,B装置中盛放的碱石灰,用来干燥氨气;装置F制取氯气,从F中制得的氯气含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水的E和盛有浓硫酸的D除去,装置C中氨气与HCl反应生成氯化铵.
(1)装置F中制取氯气,实验室用浓盐酸与二氧化锰在加热条件下制备氯气,反应生成二氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置A制取氨气,B装置中盛放的碱石灰,用来干燥氨气;从F中制得的氯气含有氯化氢和水蒸气杂质,E中盛放饱和食盐水,吸收HCl气体,
故答案为:碱石灰;干燥氨气;饱和食盐水;吸收HCl气体;
(3)装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,反应为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)氯化铵的物质的量为$\frac{10.7g}{53.5g/mol}$=0.2mol,根据N原子守恒,可知生成氨气物质的量为0.2mol,标况下制得氨气体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(5)装置C中有白烟产生,是由于氨气与HCl反应生成氯化铵,反应方程式为:NH3+HCl=NH4Cl,
故答案为:NH3+HCl=NH4Cl;
(6)氯气能与氢氧化钠溶液发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,可以用盛有氢氧化钠溶液的洗气瓶吸收,防止污染空气,
故答案为:NaOH溶液.
点评 本题考查氯气、氨气的制备和性质实验,题目难度不大,注意把握实验的原理和物质的化学性质.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、PH3、H2S稳定性依次减弱 | |
| C. | NaOH、KOH、Ca(OH)2碱性依次减弱 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
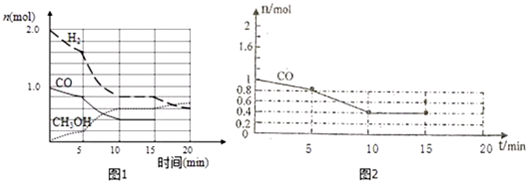
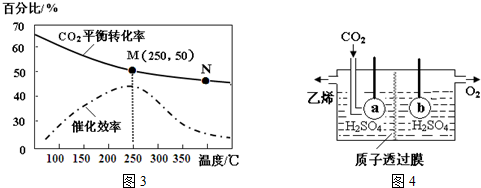
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2mol SO3气体通入一定密闭容器中,反应达到平衡后吸收Q kJ热量,则该反应的热化学方程式为 2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ•mol-1 | |
| B. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
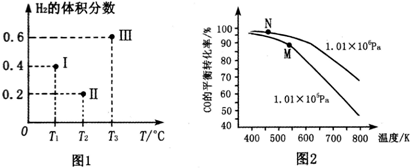
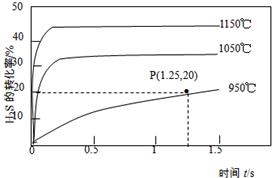 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向1mL 0.1mol/LAgNO3溶液中滴加2滴0.1mol/LNaCl溶液,振荡后,再滴加2滴0.1mol/LKI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 加热盛有浓硫酸和可抽动铜丝的试管,并将产生的气体通入到品红溶液中 | 品红溶液褪色,且试管中只产生蓝色溶液 | 浓硫酸具有强氧化性 |
| C | 向丙烯醇(HOCH2CH=CH2)中滴入少量酸性高锰酸钾溶液 | 溶液紫红色褪去 | 丙烯醇中含有碳碳双键 |
| D | 碳酸钠溶液中滴加稀硫酸后,将产生的气体通入到硅酸钠溶液中 | 产生白色沉淀 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com