
分析 (1)漂白液由氯气和NaOH溶液反应生成,主要成分是NaCl和NaClO,以此书写离子方程式;
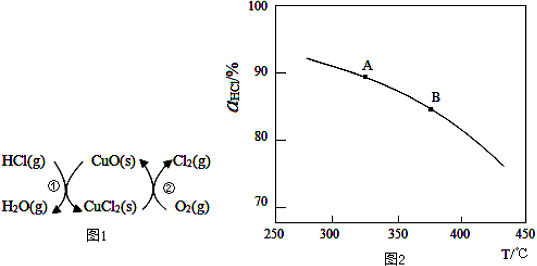
(2)依据题意可知:①2HCl(g)+CuO(s)=H2O(g)+CuCl2(s)△H1,②2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g)2△H2,依据盖斯定律:①+$\frac{1}{2}$②得:2HCl(g)+$\frac{1}{2}$O2(g)=Cl2(g)+H2O(g),据此计算总反应生成1molCl2(g)的焓变;
(3)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动;依据反应正向放热,温度升高,平衡逆向移动,平衡常数减小,判断A、B 两点的平衡常数K(A)与K(B)大小;
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大;
③改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度.
解答 解:(1)漂白液由氯气和NaOH溶液反应生成,主要成分是NaCl和NaClO,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)依据题意可知:①2HCl(g)+CuO(s)=H2O(g)+CuCl2(s)△H1,②2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g)2△H2,依据盖斯定律:①+$\frac{1}{2}$②得:2HCl(g)+$\frac{1}{2}$O2(g)=Cl2(g)+H2O(g),△H=△H1+$\frac{1}{2}$△H2;
故答案为:△H=△H1+$\frac{1}{2}$△H2;
(3)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,化学平衡常数减小,即K(A)>K(B),
故答案为:<;K(A);该反应正向放热,温度升高,平衡逆向移动,平衡常数减小;
②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大,故压缩体积使压强增大,画相应αHCl~T曲线的示意图为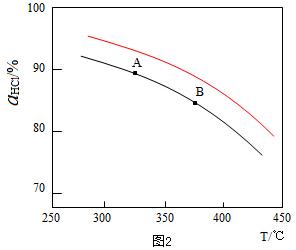 ,故答案为:
,故答案为: ;
;
③A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,故A错误;
B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,故B正确;
C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,故C错误;
D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,故D正确,
故选:BD.
点评 本题考查了离子方程式的书写、利用盖斯定律计算反应的焓变、化学平衡常数、化学平衡移动的原理,题目综合性强,难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中的还原剂是S2O32- | |
| B. | H2O参与该反应,且作氧化剂 | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
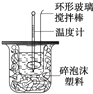 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均 值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡跟硫酸铜溶液的反应 Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| B. | 用稀硫酸清除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液 Cl-+Ag+=AgCl↓ | |
| D. | 氢氧化铁与盐酸反应 OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O也生成AlO2- | |
| B. | Mg可以常温下被氧气氧化,Al也可以常温下被氧气氧化 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Fe与S能反应生成FeS,则Cu与S也能反应生成CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol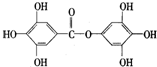 最多能与8molNaOH发生反应 最多能与8molNaOH发生反应 | |
| B. | 甲苯既能跟溴水反应又能跟酸性高锰酸钾溶液反应 | |
| C. | 向苯酚钠溶液中通入少量的CO2气体,发生反应的离子方程式为: 2 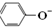 +H2O+CO2→2 +H2O+CO2→2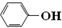 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 1mol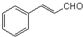 最多能和4molH2发生反应 最多能和4molH2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com