
【题目】氮的固定对人类的生存发展具有重要意义,科学家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一种固氮酶,能在常温下将空气中的氮气转化为自身生长所需的含氮化合物,下列说法错误的是____(填标号)。
a.固氮酶是一种蛋白质
b.固氮酶能降低固氮反应发生所需的能量
c.固氮酶能使固氮反应的平衡正向移动
d.固氮酶能加快固氮反应的速率
(2)合成氨是目前最重要的固氮方法。下图为合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
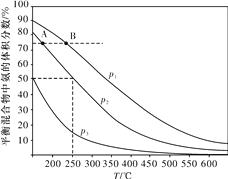
①A、B两平衡状态相比较,前者较大的是____(填标号)。
a.平衡常数
b.平衡混合物的平均摩尔质量
c.氢气的转化率
d.从反应开始至达到平衡状态所需要的时间
②图中p1、p2、p3由大到小的顺序为____。
③在250 ℃、p2下,H2的转化率为____%(结果保留小数点后一位)。
(3)据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和一种单质。已知:
①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.2 kJ/mol
2NH3(g) ΔH2=-92.2 kJ/mol
写出此条件下氮气和水反应的热化学方程式:___。
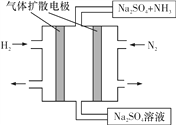
(4)下图为一种常温常压下水溶液中电化学合成氨的实验装置示意图。请据此写出其正极反应的电极反应式:__。
【答案】 c ad p1>p2>p3 66.7 2N2(g)+6H2O(l)===4NH3(g)+3O2(g) ΔH=+1529.2kJ/mol_ N2+6e-+6H2O=2NH3+6OH-(或N2+6e-+6H+=2NH3)
【解析】(1)a.酶都属于蛋白质,所以固氮酶是一种蛋白质,故a正确;b.固氮酶起到了催化剂的作用,所以固氮酶能降低固氮反应发生所需的能量,使反应在常温下就可以进行,故b正确;c.催化剂只能改变反应速率,不能影响化学平衡,所以固氮酶不能使固氮反应的平衡正向移动,故c错误;d.催化剂能够加快反应速率,所以固氮酶能加快固氮反应的速率,故d正确;故答案为:c;
(2)①a.平衡常数只受温度影响,根据图像可知,A点的温度小于B,合成氨的反应为放热反应,温度升高,平衡向着逆向移动,平衡常数减小,所以A的平衡常数大于B,故A正确;b.A、B都处于平衡状态时,氨气的体积分数相等,则氮气和氢气的体积分数也相等,则混合气体的平均摩尔质量:A=B,故B错误;c.氢气的转化率:由于A、B达到平衡状态时各组分的含量完全相同,所以氢气的转化率:A=B,故c错误;d.B的压强、温度都大于A,则B的反应速率大于A,所以B优先达到平衡状态,即从反应开始至达平衡状态所需要的时间:A>B,故d正确;故答案为:ad;
②相同温度下,压强增大,平衡正向移动,氨气的体积分数增大,氨气的体积分数关系为:p1>p2>p3,则压强大小为:p1>p2>p3,故答案为:p1>p2>p3,
③在250℃、1.0×104kPa下,初始时氮气、氢气的体积比为1:3,氨气的体积分数为50%,设氮气的转化率为x,则
N2(g)+3H2(g)2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
所以![]() =50%,解得x=
=50%,解得x=![]() ,则氢气的转化率为:
,则氢气的转化率为: ![]() ×100%≈66.7%,故答案为:66.7;
×100%≈66.7%,故答案为:66.7;
(3)①H2(g)+ ![]() O2(g)═H2O(1)△Hl═-285.6kJ/mol②N2(g)+3H2(g)═2NH3(g)△H2═-92.2kJ/mol,
O2(g)═H2O(1)△Hl═-285.6kJ/mol②N2(g)+3H2(g)═2NH3(g)△H2═-92.2kJ/mol,
氮气与水反应的化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),
根据盖斯定律,②×2-①×6可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=2△H2-6△Hl═+1529.2kJ/mol,故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1529.2kJ/mol;
(4)根据图示可知,正极上氮气得到电子发生还原反应生成氨气,电极反应式为:N2+6e-+6H2O=2NH3+6OH-,故答案为:N2+6e-+6H2O=2NH3+6OH-。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】原子序数为z的元素R,在周期表中它位于A、B、C、D四种元素的中间,如图所示,A、B、C、D 4种元素的原子序数之和为下列数据,其中不可能是
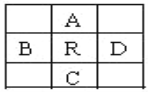
A. 4Z B. 4Z+10 C. 4Z+5 D. 4Z+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是
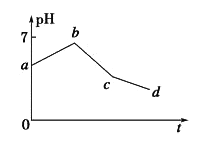
A. ab段H+被还原,溶液的pH 增大
B. cd 段相当于电解水
C. c点时加人适量CuCl2固体,电解液可恢复原来浓度
D. 原溶液中KCl和CuSO4的物质的量浓度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行的相应实验,不能达到实验目的是( ) 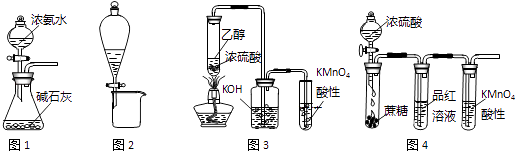
A.图1装置可制取氨气
B.图2装置可分离CH3COONa和CH3COOC2H5混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率____________;
(2)为了提高生成SO2的速率,可以采取的措施是______________;
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
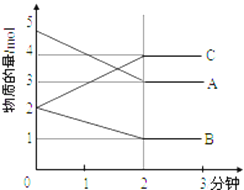
(3)该反应的化学方程式为_________________;
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是_______________
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应说法正确的是
A.氧化剂得电子越多说明氧化性越强B.氧化剂价态越高说明氧化性越强
C.Cu2+→ Cu的变化过程是还原反应D.氧化还原反应本质是元素化合价的升降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+ CO2(g)==Na2CO3(s)+1/202(g) △H=-226kJ/mol
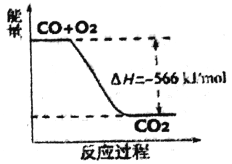
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(g)==2Na2CO3(s)+ 02(g) △H<-452kJ/mol
D. CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数约为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
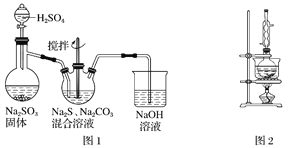
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是________________________。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除生成Na2S2O3外,还有________(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:_______________________________________________________________________。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加________作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有________。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤如下,请填写实验操作。
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示组装所需仪器,向冷凝管中通入冷却水,水浴加热;
③待________________时,停止加热,将烧瓶取下;
④____________________________________________________________________;
⑤____________________________________________________________________;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com