
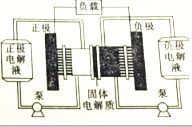
 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )| A. | 该电池应该在负极通入空气 | |
| B. | 放电时,Li+透过固体电解质向负极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+2e-═2Cu+O2- | |
| D. | 整个反应过程中,铜相当于催化剂,氧化剂实质是O2 |
分析 根据电池反应式知,该反应中Li元素化合价由0价变为+1价、Cu元素化合价由+1价变为0价,所以负极上电极反应式为Li-e-=Li+、正极反应式为 Cu2O+H2O+2e-=Cu+2OH-,放电时电解质中阳离子向正极移动,据此分析解答.
解答 解:根据电池反应式知,该反应中Li元素化合价由0价变为+1价、Cu元素化合价由+1价变为0价,所以负极上电极反应式为Li-e-=Li+、正极反应式为 Cu2O+H2O+2e-=Cu+2OH-,
A.根据反应式知,Li在负极上失电子发生氧化反应,所以不能在负极上通入氧气,故A错误;
B.放电时电解质中阳离子向正极移动,所以Li+透过固体电解质向正极移动,故B错误;
C.根据电池反应式知,正极反应式为 Cu2O+H2O+2e-=Cu+2OH-,故C错误;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选D.
点评 本题考查化学电源新型电池,正确判断正负极及正负极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是D,注意Cu的作用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 b.
b. c.
c.
 b.
b. c.CH3OCH3
c.CH3OCH3 b.
b. c.
c.
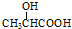 )有良好的防腐保鲜功效,广泛应用于食品行业.
)有良好的防腐保鲜功效,广泛应用于食品行业.
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
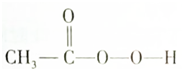 )是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )| A. | 过氧乙酸溶液与碳酸钙反应能产生二氧化碳气体 | |
| B. | 过氧乙酸与乙醇能发生酯化反应 | |
| C. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 | |
| D. | 由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
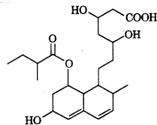 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )| A. | 分子中含有四种官能团 | |
| B. | 1 mol该物质最多可与3 mol NaOH反应 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 1 mol该物质最多可与2 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (或
(或
 );
);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com