
【题目】对于2SO2(g)+O2(g) 2SO3(g),ΔH<0,根据下图,下列说法错误的是( )

A.t2时使用了催化剂B.t3时采取减小反应体系压强的措施
C.t5时采取升温的措施D.反应在t6时刻,SO3体积分数最大
【答案】D
【解析】
A.t2时,正逆反应速率同时增大,且速率相等,而所给可逆反应中,反应前后气体分子数发生变化,故此时改变的条件应为加入催化剂,A不符合题意;
B.t3时,正逆反应速率都减小,由于逆反应速率大于正反应速率,平衡逆移,由于该反应为放热反应,故不可能是降低温度;反应前后气体分子数减小,故此时改变的条件为减小压强,B不符合题意;
C.t5时,正逆反应速率都增大,故改变的条件可能为升高温度或增大压强,由于逆反应速率大于正反应速率,平衡逆移,结合该反应为放热反应,且反应前后气体分子数减小,故此时改变的条件为升高温度,C不符合题意;
D.由于t3、t5时刻,平衡都是发生逆移的,故达到平衡时,即t4、t6时刻所得的SO3的体积分数都比t1时刻小,D说法错误,符合题意;
故答案为:D


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
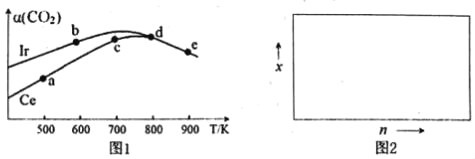
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为____,按反应的先后顺序写出该过程的离子反应方程式:___________。
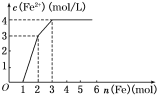
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 相对分子质量为72的某烷烃,一氯代物有8种
B. 聚合物![]() 可由单体CH2=CHCH3CH=CH2加聚制得
可由单体CH2=CHCH3CH=CH2加聚制得
C. CH3CH(OH)CH(CH3)2的名称为2-甲基-3-丁醇
D. 植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式。
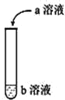
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ________________ | _________ |
稀盐酸 | Na2CO3 | ______________ | _______________ |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:
_____NaIO3+_____NaHSO3=_____I2+_____Na2SO4+_____H2SO4+_____H2O
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取![]() 。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2 (亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___(填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mo1,则CO的燃烧热的热化学方程式为____。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。
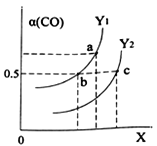
X表示的是_____,Y1___Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
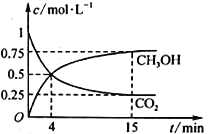
①反应进行到4min时,v(正)___v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=_____mol·L1·min1。
②该温度下平衡常数为____。
③下列能说明该反应已达到平衡状态的是____。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸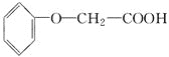 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是____________________________。
(3)菠萝酯的结构简式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有________摩尔电子通过?
(2)Zn片溶解的质量是________?
(3)原稀H2SO4的物质的量浓度是________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com