
在标准状况下,将w g A气体(摩尔质量为M g/mol)溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
A.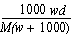 mol·L-1 B.
mol·L-1 B. 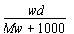 mol·L-1
mol·L-1
C.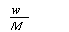 mol·L-1 D.
mol·L-1 D.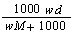 mol·L-1
mol·L-1
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:填空题
下列三组物质中,均有一种物质的类别与其它三种不同:
A.MgO、Na2O、CO2、CuO
B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):A ;B ;C 。
(2)这三种物质相互作用可生成一种新物质,写出生成该新物质的化学方程式 ,该反应 氧化还原反应(填“是”或“不是”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上10月月考化学试卷(解析版) 题型:选择题
100 mL0.6 mol·L-1盐酸加到等体积0.4 mol·L-1NaOH溶液中,所得溶液中pH是( )
A.0.2 B.0.7 C.1.0 D.2.0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:实验题
实验需要0.80 mol·L-1NaOH溶液475 mL和0.40 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,不能用容量瓶实现的有______________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.量取一定体积的液体 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_________(填”大于”、“等于”或“小于”,下同)0.8 mol·L-1。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度__________0.8 mol·L-1。
(4)根据计算得知,所需质量分数为98 %、密度为1.84 mol·L-1的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,选用___________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
如图所示为从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是
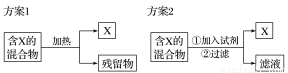
A.可以选用方案1分离碳酸氢钠中含有的碘单质
B.方案1中的残留物应该具有的性质是受热易挥发
C.方案2中加入的试剂一定能够与除X外的物质发生化学反应
D.方案2中加入稀硫酸溶液可以分离出Cu和Fe2O3混合物中的Cu
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
相等物质的量的CO和CO2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1 ②它们所含的O原子数目之比为1∶2 ③它们所含的原子数目之比为2∶3 ④它们所含的C原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学试卷(解析版) 题型:选择题
量取100 mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4 mL四氯化碳,用力振荡后静置,实验现象为
A.液体分层,上层为四氯化碳层,黄色 B.液体分层,上层为水层,紫色
C.液体分层,下层为四氯化碳层,紫色 D.液体分层,下层为水层,黄色
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:选择题
浓度为 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液100 mL中,逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
A.a点对应的沉淀,其物质的量为0.01mol
B.b点发生反应的离子方程式是:
Al3++2SO42-+2Ba2++3OH-== Al(OH)3↓+2BaSO4↓
C.沉淀质量最大值为4.66g
D.c点加入Ba(OH)2溶液的体积为250 mL
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第二次月考化学卷(解析版) 题型:实验题
绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
25℃时 | pH值 |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为__________.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是__________;在溶液中用硫酸酸化至pH=2的目的是:__________.
(3)操作IV的顺序依次为__________、冷却结晶、__________.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②____ __________________.
(5)测定绿矾产品中Fe2+含量的方法:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
(滴定时发生反应的离子方程式为:5Fe2++MnO4?+8H+→5Fe3++Mn2++4H2O)。
①滴定时盛放KMnO4溶液的仪器为 (填仪器名称)
②判断此滴定实验达到终点的方法是 。
③写出酸性高锰酸钾滴定Fe2+的离子反应方程式: 。
④计算上述样品中FeSO4·7H2O的质量分数为 (结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com