
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g) ![]() xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为________。
(2)前10 s内用M表示的化学反应速率为________。
(3)化学方程式中x值为________。
(4)在恒温恒容条件下,往容器中加入1 mol氦气,反应速率________(填“增大”、“减小”或“不变”,下同)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________。
【答案】0.2 mol·L-1 0.12 mol·L-1·s-1 1 不变 减小
【解析】
根据题意,列出三段式结合定义作答,
(1)根据三段式求解;
(2)根据定义![]() 求解;
求解;
(3)结合生成R与Q的物质的量之比等于对应的化学计量数之比作答;
(4)恒温恒容状态下,充入不反应的气体,参与反应的各物质的浓度不变,据此分析;
(5)恒温恒压状态下,充入不反应的气体,容积变大,参与反应的各物质的浓度变小,分析解答。
经10 s达平衡,生成2.4 mol R,并测得Q的浓度为0.4mol/L,Q物质的量= 0.4mol/L×2L=0.8 mol,物质的量之比等于化学计量数之比,0.8:2.4 = x:3,计算得到x = 1;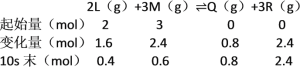
(1)10s末L的物质的量浓度 = ![]() = 0.2 mol/L,
= 0.2 mol/L,
故答案为:0.2mol/L;
(2)前10s内用M表示的化学反应速率![]()
故答案为:0.12 mol/Ls;
(3)10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1,Q物质的量=0.4 mol/L×2 L= 0.8 mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1,
故答案为:1;
(4)在恒温恒容条件,往容器中加入1mol氦气,总压增大,但各物质的浓度保持不变,其所占的分压不变平衡不动,反应速率不变,
故答案为:不变;
(5)在恒温恒压条件,往容器中加入1mol氦气,为保持恒压条件增大,压强减小,反应速率减小,
故答案为:减小。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为__________。
(3)若甲、乙、丙溶液体积均为500 mL,当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状 况),乙池中溶液PH=_______,丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
(5)某溶液中可能含有下列离子中的两种或几种:Ba2+、H+、SO42-、 SO32- 、HCO3-、 Cl-。
①当溶液中有大量H+存在时,则不可能有_______________________离子存在。
②当溶液中有大量Ba2+存在时,溶液中不可能有_________________离子存在。
③采用惰性电极从上述离子中选出适当离子组成易溶于水的电解质,对其溶液进行电解若两极分别放出气体,且体积比为1∶1,则电解质化学式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电离方程式:
①H2SO4: ________
②NaOH: ________
③Fe2(SO4)3: ________
(2)写出下列化学反应的离子方程式:
①氢氧化钠与盐酸反应:________
②铁片与硫酸的反应:________
③硫酸铜与氢氧化钡的反应:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2 (g)+O2 (g)![]() 2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙>2p乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+![]() O2(g)===CO(g) ΔH=-111 kJ·mol1
O2(g)===CO(g) ΔH=-111 kJ·mol1
①该催化重整反应的ΔH=____ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2·L2。下列可判断该反应达到平衡的是_________(填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______(填“>”、“=”或“<”)0。
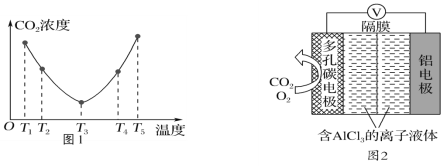
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________。
电池的正极反应式:6O2+6e-=6O;6CO2+6O=3C2O42-+6O2
反应过程中O2的作用是_________________。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
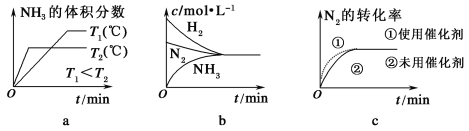
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室制氢气的反应:Zn+2HCl= ZnCl2+H2↑。现用13.0gZn粉与一定量2mol/L稀盐酸充分反应,一段时间后Zn粉无剩余.
(1)用双线桥或单线桥标出电子转移的方向和数目
(2)比较H+和Zn2+氧化性强弱
(3)消耗盐酸的体积至少为多少升?
(4)生成ZnCl2的物质的量为多少?
(5)标准状况下,最多能收集到多少升气体?
(6)反应中转移的电子的个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时液氨中存在着下列平衡:2NH3(液)![]() NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
NH4++NH2-,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时离子积的叙述中正确的是( )
A. 离子积为1.0×10-15
B. 离子积为1.0×10-30
C. 向液氨中加入氨基钠(NaNH2),液氨的离子积增大
D. 向液氨中加入NH4Cl,c(NH4+)增大,离子积的数值也随之增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
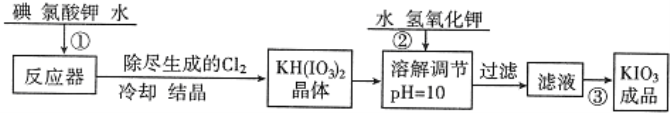
(1)已知步骤①反应器中发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,反应器中发生的化学方程式为6I2+11KClO3+3H2O→6KH(IO3)2+5KCl+3Cl2↑。参照碘酸钾的溶解度:
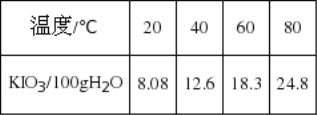
操作③得到碘酸钾晶体,方法是____________、____________:
(2)已知: KIO3+ 5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32—=2I—+S4O62—
检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有____________
(3)检验加碘食盐中碘的含量,学生乙设计的实验步骤如下:
①准确称取wg食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
③以淀粉为指示剂,逐滴加入2.0╳10—3mol/L的Na2S2O310.0mL,恰好反应完全。
则加碘食盐样品中的碘元素含量是_____ mg/kg (以含w 的代数式表示)。
(4)学生丙又对纯净的NaCl进行了下列实验:

请推测实验中产生蓝色现象的可能原因____________,用化学方程式表示。
(5)根据学生丙的实验结果,学生乙测得的食盐中碘元素的含量可能____________ (填“偏高”、“偏低"或“准确")。原因是____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com