

分析 钛铁矿与硫酸反应:FeTiO3+H2SO4→TiOSO4+FeSO4+H2O,然后过滤出未被酸溶解的物质,将所得到的滤液中加入铁粉可以得到了绿矾,将滤液控制在一定的条件,让TiOSO4水解:TiOSO4+2H2O═TiO(OH)2↓+H2SO4,将过滤出的沉淀进行煅烧,可以得到钛白粉(TiO2).
(1)则根据元素守恒得:FeTiO3~TiO2,根据FeTiO3的质量1t×76%×92%×96%,来计算二氧化钛的质量;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
(2)根据原子守恒可以得而X的化学式,存在元素的化合价改变的反应为氧化还原反应;
(3)从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;从溶液中得到晶体的操作为结晶后过滤;铁粉与可能生成的+3价的铁反应生成+2价的铁;
(4)根据水解原理:TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-来书写方程式.
解答 解:钛铁矿与硫酸反应:FeTiO3+H2SO4→TiOSO4+FeSO4+H2O,然后过滤出未被酸溶解的物质,将所得到的滤液中加入铁粉可以得到了绿矾,将滤液控制在一定的条件,让TiOSO4水解:TiOSO4+2H2O═TiO(OH)2↓+H2SO4,将过滤出的沉淀进行煅烧,可以得到钛白粉(TiO2).
(1)设得到二氧化钛的质量是m,则根据元素守恒得:
FeTiO3~TiO2
152 80
1t×76%×92%×96% m
m=0.31t,在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
故答案为:0.31;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
(2)在FeTiO3中Ti为+4价故Fe为+2价,反应后铁元素的化合价没有发生改变,钛元素化合价也没有发生改变,其他元素的化合价都没发生改变,故此反应为非氧化还原反应,根据原子守恒可以得而X的化学式为FeSO4,
故答案为:FeSO4;
(3)在操作I从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;在操作II加入铁粉后得到了绿矾,故应是从溶液中得到晶体的操作为结晶后过滤;在操作II加入铁粉的目的是为了防止在制备过程中钛铁矿+2价的铁生成+3价的铁使制备的绿矾中含有杂质,故应加入铁粉与可能生成的+3价的铁反应生成+2价的铁,
故答案为:过滤;过滤、洗涤、干燥;Fe+2Fe3+═3Fe2+;
(4)TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-,故反应为TiOSO4+2H2O═TiO(OH)2↓+H2SO4,
故答案为:TiOSO4+2H2O═TiO(OH)2↓+H2SO4.
点评 本题考查物质的制备实验方案的设计,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,为高考常见题型,明确制备流程及反应原理为解答关键,注意把握实验的基本原理和常见物质的性质.


科目:高中化学 来源: 题型:解答题
 双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题:
双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题: +4NaOH→2
+4NaOH→2 +NaOOCCOONa+2CH3CH2OH;
+NaOOCCOONa+2CH3CH2OH; ,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式
,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式 ,写出合成CPPO的化学方程式ClOC-COCl+2
,写出合成CPPO的化学方程式ClOC-COCl+2 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +2HCl,该反应是有一定限度的,加入有机碱三乙胺[(C2H5)3N]能提高目标产物的产率,其原因是有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移,;
+2HCl,该反应是有一定限度的,加入有机碱三乙胺[(C2H5)3N]能提高目标产物的产率,其原因是有机碱三乙胺能跟反应⑧的生成物HCl发生反应,使合成双草酸酯的平衡右移,; 与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n
与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n +nClOC-COCl$\stackrel{一定条件}{→}$
+nClOC-COCl$\stackrel{一定条件}{→}$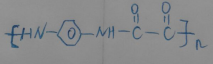 +2nHCl.
+2nHCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水中,25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | 25℃时,任何以水为溶剂的稀溶液中c(H+)•c(OH-)=1×10-14 | |
| D. | KW值随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②③④ | C. | ②③④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2═2Na++CO${\;}_{3}^{2-}$+H2SiO3 | |
| B. | Na202加入H2180中:2Na2O2+2H${\;}_{2}^{18}$O═4Na++4OH-+${\;}_{\;}^{18}$O2↑ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 过量C02通入氢氧化钙溶液中:CO2+OH-═HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgC12溶液:2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+C12↑+2OH- | |
| B. | H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ | |
| C. | 硫酸氢钠溶液中加入少量氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层比Y原子的电子层数多 | |
| B. | X原子的最外层电子比Y原子的最外层电子多 | |
| C. | X的单质能将Y从NaY的溶液中置换出来 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑥ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com