
【题目】如图所示,△H1=﹣393.5kJmol﹣1 , △H2=﹣395.4kJmol﹣1 , 下列说法或表示式正确的是( ) 
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJmol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
【答案】C
【解析】解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1②C(S,金刚石)+O2(g)=CO2(g)△H=﹣395.4kJmol﹣1 ,
利用盖斯定律将①﹣②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJmol﹣1 , 则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJmol﹣1 , 故A错误;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C正确;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJmol﹣1 , 1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D错误;
故选C.
先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.


科目:高中化学 来源: 题型:
【题目】在澄清透明的强酸性溶液中能大量共存的离子组是( )
A. NH4+、Mg2+、SO42、Cl- B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D. Na+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3)PH3具有较强的还原性,能在空气中自燃.我国粮食卫生标准规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg. 某化学兴趣小组的同学通过下列方法对粮食中残留磷化物含量进行研究:
【实验课题】
【实验原理】
5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
【操作流程】
安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸钠标准溶液滴定
【实验装置】
A、D、E、F各装1.00mL浓度为5.00×10﹣4 mol/L的酸性KMnO4溶液,B中装碱性焦性没食子酸(1,2,3﹣三羟基苯),C中装200g原粮.
(1)实验课题的名称是 .
(2)以磷化铝为例,写出磷化物与水反应的化学方程式 .
(3)检查上述装置气密性的方法是 .
(4)A中盛装KMnO4溶液是为除去空气中可能含有的(填“氧化性”、“还原性”) 气体;B中盛装碱性焦性没食子酸溶液的作用是;如去除B装置,则实验中测得的PH3含量将(填偏大、偏小或不变).
(5)将D、E、F三装置中的吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为2.5×10﹣4 mol/LNa2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为mg/kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,A、B、C、D、E、X 是元素周期表给出元素组成的常见单质或化合物.已知 A、B、C、D、E、X 存在如图2所示转化关系(部分生成物和反应条件略去). 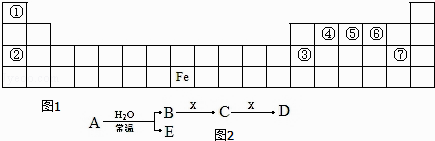
(1)若 E 为氧化物,则 A 与水反应的方程式为 , 该反应中氧化剂和还原剂物的量之比为 . ①当 X 为碱性盐溶液,C分子中有 22 个电子时,D 是(写化学式).
②当 X 为金属单质时,X 与足量 B 的稀溶液反应生成 C 的离子方程式为 , 写出检验生成物 C 的阳离子所用试剂的电子式 .
(2)若 E 为单质气体,D 为白色沉淀,A 可能是(写化学式),X是(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①苯和水②乙醇和丁醇③单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行NaCl溶液蒸发时,一般有以下操作过程①固定铁圈位置②放置酒精灯③放上石棉网④放上蒸发皿⑤加热搅拌⑥停止加热、余热蒸干,其操作顺序为
A.①②③④⑤⑥B.②①③④⑤⑥C.②①④⑤⑥D.②①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 2 L 的密闭容器中,X、 Y、 Z 三种气体的物质的量随时间 t(单位为分钟)变化的曲线如右图,下列描述正确的是

A. t 分钟时该反应达到化学平衡状态
B. 反应开始到10分钟,用 X表示的反应速率为 0.079mol·L-1·min-1
C. 反应开始到10 分钟时, Y 的转化率为 79.0%
D. 反应的化学方程式为: X(g) + 2Y(g) ![]() 3Z(g)
3Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com