
| Y | Z | ||
| M | X |
| A. | 原子半径Z<M | |
| B. | 非金属性:X<Z | |
| C. | M元素最高价氧化物对应水化物具有两性 | |
| D. | Y的最高价氧化物对应水化物的酸性比X的弱 |
分析 由四种短周期元素在周期表中的位置可知,Y、Z处于第二周期,M、X处于第三周期,其中只有M元素原子最外层电子数与电子层数相等,则M为Al,可推知X为Si、Y为N、Z为O.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大;
B.同周期随原子序数增大元素非金属性增强,同主族自上而下元素非金属性减弱;
C.氢氧化铝是两性氢氧化物;
D.非金属性越强,最高价氧化物对应水化物的酸性越强.
解答 解:由四种短周期元素在周期表中的位置可知,Y、Z处于第二周期,M、X处于第三周期,其中只有M元素原子最外层电子数与电子层数相等,则M为Al,可推知X为Si、Y为N、Z为O.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Z<M,故A正确;
B.同周期随原子序数增大元素非金属性增强,同主族自上而下元素非金属性减弱,故非金属性:X<Z,
故B正确;
C.氢氧化铝溶于强酸、强碱生成相应的盐与水,是两性氢氧化物,故C正确;
D.同周期随原子序数增大元素非金属性增强,同主族自上而下元素非金属性减弱,故非金属性X<Y,非金属性越强,最高价氧化物对应水化物的酸性越强,故D错误,
故选D.
点评 本题考查元素周期表与元素周期表,侧重对元素周期律的考查,注意整体把握元素周期表的结构、理解元素周期律,难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③④ | C. | 只有① | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡使用太阳能、风能、天然气、地热能等新能源,以保护环境 | |
| B. | “玉兔号”的太阳能电池板主要由二氧化硅制成 | |
| C. | 为除去锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加盐酸溶解 | |
| D. | 碱性洗涤剂的去污能力比中性洗涤剂弱,是由于油脂在中性溶液中更易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60、D2O、SiO2都属于化合物 | |
| B. | 漂白粉、石英、Fe(OH)3胶体都属于纯净物 | |
| C. | BaSO4、NH4Cl、NaOH都属于强电解质 | |
| D. | CO2、SO3、NO 都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
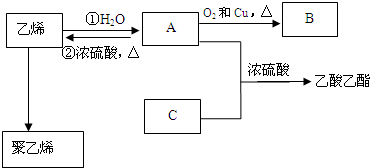
 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基. $→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中混合气体的平均相对分子质量增大 | |
| B. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 正反应速率和逆反应速率都变小,C的百分含量增加 | |
| D. | 混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一块表面被氧化的铝分成两等分,若向其中一份中滴加1mol•L-1的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )
一块表面被氧化的铝分成两等分,若向其中一份中滴加1mol•L-1的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )| A. | 该铝块的总质量为8.46g | |
| B. | a=260 | |
| C. | b=780 | |
| D. | 该铝块中氧化铝与铝单质的物质的量之比为3:20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com