
常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
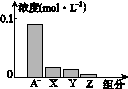
A.HA为强酸
B.该混合溶液pH=7.0
C.该混合溶液中:c(A-)+c(Y)=c(Na+)
D.图中X表示HA,Y表示OH-,Z表示H+
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO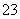
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO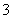 )+c(CO
)+c(CO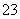 )
)
D. 温度升高,c(HCO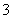 )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
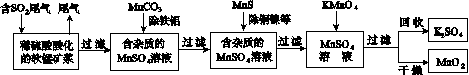
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是____________________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.0.1 mol/L (NH4)2SO4溶液中的c(NH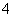 )<c(SO
)<c(SO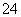 )
)
B.相同温度下,0.6 mol/L氨水溶液和0.3 mol·L-1氨水溶液中c(OH-)之比是2∶1
C.向0.1 mol/L NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO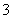 )
)
D.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O===2NaOH+H2↑
B.Fe2O3+3CO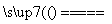 2Fe+3CO2
2Fe+3CO2
C.Cl2+2FeCl2===2FeCl3
D.3O2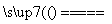 2O3
2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
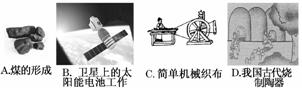
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
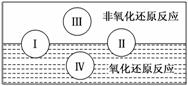
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
________________________________________________________________________,
其中水为________剂。
(3)氯化铵常用作焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl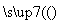 ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称) ,氧化剂是____________(填化学式)。
,氧化剂是____________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ mol的电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是( )
A.苯中含苯酚杂质:加入溴水,过滤
B.乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C.乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D.乙酸丁酯中含乙酸杂质:加入碳酸钠溶液洗涤,分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com