
| A、0.250 mol/L |
| B、0.225 mol/L |
| C、0.150 mol/L |
| D、0.450 mol/L |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 0.45mol |
| 1L+1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氮氧化铝中氮的化合价是-3 |
| B、反应中每生成5.7g AlON 同时生成1.12 L CO |
| C、反应中氧化产物和还原产物的物质的量之比是2:1 |
| D、反应中氮气作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④⑤⑦ |
| C、①③⑤⑦ | D、①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 结论 |
| ①将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中 | _ | _ |
| ②向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解. | 固体完全溶解 | 证明猜想 |
| ③向另一试管中加入足量的 | 固体完全溶解 | 猜想 |
| 得出结论:综合实验②③的现象,可推知猜想 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
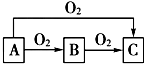 ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:
ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com