
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有着重要应用。回答下列问题:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时还生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为___。
II.H2S可用于检测和沉淀金属阳离子。
(2)由H2S制得的水溶液为氢硫酸,向氢硫酸中滴加少量的硫酸铜溶液,溶液中![]() ___(填“增大”或“减小”)。
___(填“增大”或“减小”)。
(3)已知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=___(溶液体积变化忽略不计)。
III.H2S是煤化工原料气脱硫过程的重要中间体,反应原理如下:
i.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ·mol-1;
H2S(g)+CO(g) △H=+7kJ·mol-1;
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ·mol-1。
CO2(g)+H2(g) △H=-42kJ·mol-1。
(4)已知:断裂1mol分子中的化学键所需吸收的能量如下表所示:
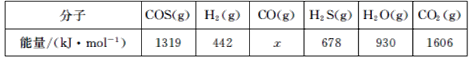
表中x=___。
(5)向10L溶积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),进行上述两个反应。
①随着温度升高,CO的平衡体积分数___(填“增大”或“减小”),其原因是___。
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,CO的体积分数为5%。则该温度下,达到平衡时H2的物质的量为___;反应i的平衡常数为___(保留两位有效数字)。
【答案】4SO2+3CH4![]() 4H2S+3CO2+2H2O 减小 8.0×10-3mol/L 1076 增大 反应i为吸热反应,升高温度,化学平衡向正反应方向进行,CO的体积分数增大,反应ii为放热反应,升高温度化学平衡向逆反应方向移动,CO的体积分数也增大 0.85mol 0.044
4H2S+3CO2+2H2O 减小 8.0×10-3mol/L 1076 增大 反应i为吸热反应,升高温度,化学平衡向正反应方向进行,CO的体积分数增大,反应ii为放热反应,升高温度化学平衡向逆反应方向移动,CO的体积分数也增大 0.85mol 0.044
【解析】
I.(1)工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物,从元素角度考虑,这两种氧化物为CO2和H2O,反应产生H2S;
II.(2)H2S的第一步电离产生H+和HS-,Cu2+与HS-反应生成CuS沉淀和H2S,据此分析判断;
(3)根据溶度积常数计算;
III.(4)根据盖斯定律计算,△H=反应物总键能-生成物总键能;
(5)①根据方程式和图象分析,升高温度,CO的平衡体积分数增大,升高温度使化学反应平衡向吸热方向进行;
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,此时CO的平衡体积分数为5%,根据方程式计算平衡时H2的物质的量,将各组分平衡浓度代入平衡常数表达式计算反应i的平衡常数。
I.(1)工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物,从元素角度考虑,这两种氧化物为CO2和H2O,反应产生H2S,则该反应的化学方程式为:4SO2+3CH4![]() 4H2S+3CO2+2H2O,故答案为:4SO2+3CH4
4H2S+3CO2+2H2O,故答案为:4SO2+3CH4![]() 4H2S+3CO2+2H2O;
4H2S+3CO2+2H2O;
II.(2)H2S的第一步电离产生H+和HS-,是不完全电离,Cu2+与HS-反应生成CuS沉淀和H2S,则溶液中![]() 减小,故答案为:减小;
减小,故答案为:减小;
(3)向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(S2-)=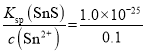 =1.0×10-24mol/L,则溶液中c(Cd2+)=
=1.0×10-24mol/L,则溶液中c(Cd2+)= =8.0×10-3mol/L,故答案为:8.0×10-3mol/L;
=8.0×10-3mol/L,故答案为:8.0×10-3mol/L;
III.(4)根据反应i:COS(g)+H2(g)H2S(g)+CO(g)△H=+7kJ/mol,由△H=反应物的总键能-生成物的总键能可得,△H=1319+442-678-x=7,可得x=1076,故答案为:1076;
(5)①根据方程式和图象分析,升高温度,CO的平衡体积分数增大,升高温度使化学反应平衡向吸热方向进行,反应i为吸热反应,升高温度,化学平衡向正反应方向进行,CO的体积分数增大,反应ii为放热反应,升高温度化学平衡向逆反应方向移动,CO的体积分数增大,综合两个反应考虑,CO的体积分数随着温度升高而增大,故答案为:增大;反应i为吸热反应,升高温度,化学平衡向正反应方向进行,CO的体积分数增大,反应ii为放热反应,升高温度化学平衡向逆反应方向移动,CO的体积分数也增大;
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,此时CO的平衡体积分数为5%,反应起始时,向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),则COS的平衡转化率为α=![]() ×100%=20%,则
×100%=20%,则
反应i的方程式:

反应ii的方程式:
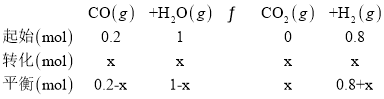
CO的平衡体积分数为5%,则0.2-x=3×5%,可得x=0.05,则平衡时c(COS)=![]() =0.08mol/L,c(H2)=
=0.08mol/L,c(H2)=![]() mol/L=0.085mol/L,n(H2)= 0.085mol/L×10L=0.85mol,因此反应i的化学平衡常数为
mol/L=0.085mol/L,n(H2)= 0.085mol/L×10L=0.85mol,因此反应i的化学平衡常数为
![]() ,故答案为:0.85mol;0.044。
,故答案为:0.85mol;0.044。


科目:高中化学 来源: 题型:
【题目】实验室可用二氧化锰和浓盐酸共热制取氯气。为了证明得到的氯气中含氯化氢,并测定氯化氢的含量进行了下列实验。请回答:
(1)向饱和NaCl溶液中滴入少量浓盐酸,会有白色晶体析出,该晶体的化学式是_____。
(2)按如图装置,将所得气体通入后,试管内白色晶体析出,能否证明氯气中含有HCl,说明理由_____。b装置的作用是_____。

(3)已知氯气易溶于CCl4,按图中装置实验试管③中有白色沉淀,能够证明含HCl,说明理由_____。用浓盐酸与二氧化锰加热经干燥得到1.12L(标况下)气体,除去Cl2后,用水全部吸收并定容至100mL,再通过滴定测HCl气体含量。

(4)定容所需要仪器有烧杯、玻璃棒、________和_____。
(5)取定容后溶液20.00mL,加入2滴酚酞试液,用0.0250mol/L标准NaOH溶液滴定,当______即为滴定终点,消耗NaOH溶液19.20mL,则得到的气体中氯化氢的体积含量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。
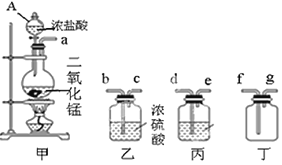
(1)装置甲中仪器A的名称是__,丙中应装的溶液是__,甲装置中发生反应的离子方程式为__。制取收集纯净氯气的装置接口连接顺序是a→…→g__(补充完整)。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
①方案:采用酸碱中和滴定法测定。
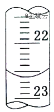
②进行方案实验:准确量取残余清液稀释一定倍数后作为试样。
量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?__(填“是”或“无”)。用0.10molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如右图所示,其读数为__mL。
(3)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.将足量Zn与100mL18mol/L 浓硫酸反应,生成224mL气体,转移电子为0.02NA
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等
D.常温常压下,92 g的NO2和N2O4混合气体中含有的氮原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,用化学用语回答下列问题:

(1)元素Fe在周期表中的位置为________。
(2)⑦与⑧形成的化合物中各原子均满足8电子稳定结构的是_____。(用化学式表示)
(3)④、⑦、⑧三种元素的非金属性由强到弱的顺序是________。(用元素符号表示)
(4)用电子式表示含元素⑥的10电子二元化合物的形成过程________。
(5)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是

A. 辛酸在常温下呈气态
B. 辛酸的酸性比醋酸强
C. 辛酸和油酸(C17H33COOH)二者属于同系物
D. 辛酸的同分异构体(CH3)3CCH(CH3) CH2COOH的化学名称为3,4,4一三甲基戊酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A是有机合成中重要的原料,由A制取高聚物M的流程如下:

请回答下列问题:
(1)反应②的反应类型为___________。
(2)E中的官能团名称是___________。
(3)反应②的条件是___________。
(4)写出A和F的结构简式:A___________;F___________。
(5)符合下列条件的E的同分异构体有___________种(不考虑立体异构)。
①含有相同官能团
②遇FeCl2能发生显色反应
③苯环上连有三个取代基
(6)写出下列化学反应方程式:
反应③___________,D与新制Cu(OH)2悬浊液反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础](15分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
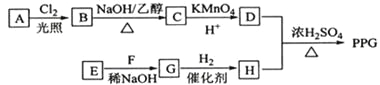
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]() 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量的NaHCO3反应得到V2 L二氧化碳,若2V1=V2≠0,则此有机物可能是 ( )
A. CH3CH(OH)COOHB. HOOCCH2COOH
C. HOCH2CH2OHD. HOCH2CH(OH)CH2COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com