
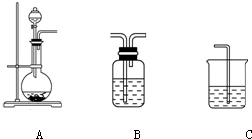
 (1)下列实验操作或对实验事实的描述正确的有
(1)下列实验操作或对实验事实的描述正确的有| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | H2O | 浓氨水 | |
| 圆底烧瓶中试剂 | KMnO4 |
| O2 | Cl2 | NH3 |
| 浓盐酸 | ||
| 过氧化钠 | 碱石灰或氧化钙或氢氧化钠 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、能使甲基橙变黄的溶液中:Al3+、Na+、SO42-、CO32- | ||
| B、能与铝反应产生氢气的溶液:Na+、Fe2+、Cl-、NO3- | ||
C、
| ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、K+ | 稀硫酸 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | 氢氧化钠溶液 | HCO3-+OH-═CO+H2O |
| D | Al3+、Cl-、NO3- | 过量氢氧化钠溶液 | Al3++3OH-═Al(OH)3↓ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||||||||||||
| ⑧ | ⑨ | ⑩ | |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M1 |
| NA |
| X |
| NA |
| M2 |
| NA |
| Y |
| NA |
| m |
| V |
| m |
| M1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B元素原子的电子排布式为1S22S22P63S23P5 |
B、化合物AB的电子式为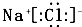 |
C、化合物AB的电子式为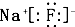 |
| D、A与水反应的离子方程式为Na+H2O═OH-+Na++H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com