
【题目】下列说法正确的是( )
A.水的离子积常数Kw只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,向10 mL pH=3的CH3COOH溶液中加水稀释后,溶液中![]() 的值减小
的值减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,![]() 的值增大
的值增大
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.浓硫酸、浓盐酸和浓硝酸长期暴露在空气中,质量都会减小、浓度都会降低
B.氯水和活性炭都可使红墨水褪色,其原理相同
C.浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
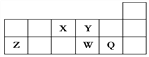
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于FeCl3溶液和Fe(OH)3胶体的说法中正确的是( )
A.都是无色透明、均一、稳定的分散系 B.分散质颗粒直径都在1~100 nm之间
C.Fe(OH)3胶体具有丁达尔效应 D.FeCl3溶液具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,正确的是( ) ①臭氧可用于漂白和消毒
②碳酸氢钠可用于治疗胃酸过多
③二氧化硅可用于制作光导纤维
④硅酸钠具有阻燃防火性能.
A.只有①②
B.只有②③
C.只有①②③
D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等实验的装置示意图。
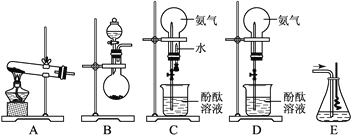
请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式_________________;制出的氨气应使用________________法来收集,要得到干燥的氨气可选用____________做干燥剂。
(2)学生乙用图B所示装置也制出了氨气,他选用的制取试剂可能是__________和____________。
(3)学生丙用图C所示装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是____________________。
(4)学生丁将装置C误装为装置D,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法:___________________。
(5)学生戊用装置E(盛有水)吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入E装置的锥形瓶内,看到了具有催化作用的铂丝保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:___________________。
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4 (g)![]() N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是_________________
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c. N2H4 和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
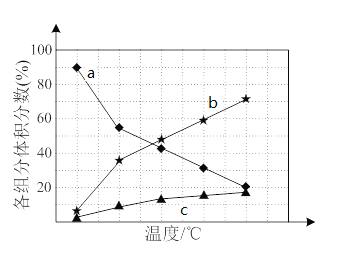
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示,其中曲线b表示的是________(物质的化学式)的体积分数随温度的变化情况,为抑制肼的分解,可采取的合理措施有___________________(任写一种)。
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
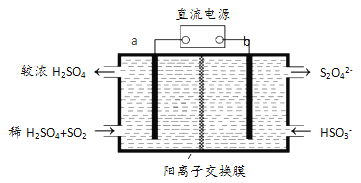
a极为 _________(填“阴”“阳”) b极的电极反应式为__________________。简述该装置能吸收SO2的原理:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com